

Eduardo Büchele Rodrigues1; Marcos Pereira de Ávila2; Lutz Hesse1; Thomas Schanze3; Peter Kroll1
DOI: 10.1590/S0004-27492004000200032
RESUMO
O sucesso recente no desenvolvimento de uma prótese eletrônica coclear para surdos estimulou vários grupos de cientistas ao desenvolvimento de próteses visuais. A maioria dos protótipos de próteses visuais está baseada em estimulação elétrica neuronal em diferentes localizações do sistema visual até o sistema nervoso central. Atualmente os esforços estão concentrados em três localizações de implantes visuais: retina, nervo óptico e córtex. Implantes de retina e do nervo óptico têm o potencial de restabelecer a visão em pacientes com degenerações retinianas progressivas por meio de estimulação elétrica de neurônios do sistema visual. Próteses corticais podem beneficiar um número maior de pacientes cegos devido à sua localização mais posterior no sistema visual. Apesar dos grandes avanços, torna-se ainda necessária a elucidação de questões importantes na avaliação do funcionamento, em longo prazo, dos vários implantes eletrônicos para cegos, em estudo. Neste artigo analisamos os motivos que justificam o início dos experimentos nas três posições mencionadas e os desafios advindos de tal decisão.
Descritores: Degeneração macular; Envelhecimento; Eletrodos implantados; Implante de prótese; Retina; Retinite pigmentosa; Córtex visual; Estimulação elétrica; Nervo óptico; Glaucoma
ABSTRACT
Recent success in the development of a prosthesis for the deaf patient encouraged several groups of scientists to develop and investigate a visual prosthesis. Visual prosthesis are based on neuronal electrical stimulation at different locations along the visual pathways, and three localizations of visual prosthesis are being researched, retina, optic nerve, and cortex. Retina and optic nerve implants may restore vision in patients with progressive retinal degenerations by means of electrical stimulation of visual pathway neurons. Cortex prosthesis may restore vision in a greater number of blind patients due to the more posterior location in the visual pathway. While major advances have been made in the field of visual prosthesis for the blind, a number of key questions remain to render a visual prosthesis feasible. Yet, investigation is justified regarding the long-term effects and functioning of the various electronic implants. Here we review shortly the rationale for such treatment, the three different possibilities of stimulating the visual pathway, and what are the challenges yet to be surpassed.
Keywords: Macular degeneration; Aging; Electrodes, implanted; Prosthesis implantation; Retina; Retinitis pigmentosa; Visual cortex; Electric stimulation; Optic nerve; Glaucoma
INTRODUÇÃO
A cegueira total ou parcial pode ser causada por centenas de patologias visuais, de forma reversível ou não. Dentre as formas irreversíveis se destacam, por sua prevalência, as degenerações retinianas, a degeneração macular relacionada à idade (DMRI) e a retinite pigmentosa (RP). Apesar do grande avanço terapêutico, são pequenas as possibilidades de reversão.
Cientistas tentam estimular a percepção luminosa de pacientes cegos desde a introdução da eletricidade no século XVIII. O sucesso dos implantes cocleares e o avanço da ciência nas últimas décadas viabilizaram o conceito de visão artificial e os testes com métodos mais confiáveis deixam entrever a real possibilidade de se criar uma prótese visual para recuperação da visão do cego(1).
Deficiências visuais ou cegueira - O problema
Lesões em qualquer parte do sistema visual, do globo ocular até o córtex visual, podem causar cegueira, irreversível ou não. As opacidades de meio ópticos intra-oculares, como distrofias corneanas ou catarata, podem ser tratadas com grande índice de sucesso, por transplante de córnea, cirurgia de catarata e implantes de lentes intra-oculares, respectivamente. A maioria dos pacientes com descolamentos de retina ou hemorragia vítrea tem a acuidade visual restabelecida por técnicas modernas de cirurgia vítreo-retinianas. No entanto, algumas causas de cegueira total ou central, como aquelas causadas por lesões degenerativas retinianas como RP ou DMRI apresentam poucas opções terapêuticas, especialmente para pacientes em estágios avançados da doença.
A - Perda visual relacionada ao nervo óptico e ao córtex visual
A perda visual relacionada ao nervo óptico ou ao córtex visual pode ser causada por muitas doenças. O glaucoma no estágio final (doença ocular atualmente considerada como neuropatia), é uma das causas não tratáveis de cegueira no mundo ocidental. A neuropatia óptica e as doenças inflamatórias do nervo óptico são outras causas importantes de cegueira ligadas ao nervo óptico(2-4).
De forma menos freqüente do que as doenças do nervo óptico ou da retina, as doenças no córtex cerebral também podem causar cegueira. Hipotensão, doença vascular cerebral, meningite, e tumores cerebrais são alguns exemplos de causas de cegueira a nível central ou cerebral, caracterizando-se, na maioria das vezes, por deficiência na acuidade visual binocular simétrica, defeitos no campo visual, fundo de olho normal, e reações pupilares normais(2).
B - Doenças retinianas causando cegueira
As doenças retinianas podem acometer qualquer camada retiniana e, freqüentemente, o corpo vítreo ou a coróide são afetados concomitantemente. Respondem por, aproximadamente, 50% das causas de cegueira irreversível(5).
B. 1 - Doenças retinianas causando cegueira por lesão nos fotorreceptores e epitélio pigmentar da retina
B. 1. a - Retinite Pigmentosa
Agrupam-se como RP diversas doenças degenerativas caracterizadas por disfunção retiniana progressiva envolvendo os fotorreceptores e, subseqüentemente, outras células da parte posterior da retina. Estima-se uma incidência de 1:3000, equivalente a cerca de um milhão e meio de pessoas afetadas no mundo(6). A idade de aparecimento da doença é variável e está associada a fatores genéticos. Os achados clínicos mais freqüentes são a cegueira noturna e perda progressiva de campo visual. Como sinais fundoscópicos destaca-se o estreitamento vascular, migração do epitélio pigmentar e formação de espículas ósseas. Apesar de a RP causar, primariamente, cegueira por lesão dos fotorreceptores, eventualmente ocorre atrofia do epitélio pigmentar da retina. Muitos pacientes em estágios finais da doença têm acuidade visual muito baixa, em nível de apenas percepção luminosa(7).
A reversão da perda de fotorreceptores na RP ainda não se beneficia de ação terapêutica eficaz, apesar de muitas tentativas. Sugere-se o uso de altas doses de vitamina A, para diminuir a velocidade de progressão de muitas formas da doença(8-9).
Tenta-se, de forma incipiente e com resultados pouco estimulantes, alterar a expressão do gene ou introduzir um gene dentro do genoma(10). Uma tentativa terapêutica promissora é a substituição do epitélio pigmentar da retina degenerada, através de transplante, por seus respectivos tipos celulares. Registram-se ensaios clínicos, com utilidade ainda não definida, para transplantes de retina e do epitélio pigmentar da retina (EPR) e terapia genética(11).
B. 1. b - Degeneração Macular Relacionada à Idade
A DMRI é a causa mais comum de cegueira central em pacientes acima de 65 anos de idade em países desenvolvidos e a segunda causa em pacientes entre 45-64 anos de idade(12). Vários fatores de risco estão envolvidos como hereditariedade, sexo, luz solar, pigmentação da pele, doença cardiovascular, uso de tabaco(13-14).
Alterações degenerativas do EPR precedem ou acompanham as lesões nos fotorreceptores e estão associadas à cegueira e à DMRI(15). Apesar de alguns pacientes conseguirem manter bons níveis de acuidade visual, há casos em que a visão chega a 5/80.
A DMRI manifesta-se sob as formas seca e úmida. O sinal clínico mais precoce na forma seca é o desenvolvimento de drusas, que são depósitos extracelulares situados entre a membrana basal do EPR e a zona de colágeno da membrana de Bruch. A forma atrófica ou geográfica leva à perda significante da acuidade visual na maioria dos casos, quando pequenas lesões iniciais coalescem com o tempo até envolver toda a região macular. A forma úmida inclui a neovascularização ou membrana neovascular (MNSR), termo utilizado para descrever o crescimento de vasos anormais abaixo do EPR ou da retina neurosensorial. A MNSR é uma alteração também encontrada em muitas doenças em que a integridade do EPR, membrana de Bruch e coriocapilares estão afetados.
A MNSR pode se apresentar clinicamente através de descoloração amarelo-acinzentada abaixo do EPR, sangramento ou descolamento da retina neurossensorial e/ou do EPR, cujo diagnóstico se comprova através de exames com a angiofluoresceinografia e a indocianina verde(16). Quando os neovasos são substituídos por tecido fibroso surge a cicatriz disciforme.
Há diversos procedimentos terapêuticos disponíveis e outros sob investigação para o tratamento (ou "controle" do crescimento) da MNSR(17). Um tratamento comprovadamente capaz de reduzir a progressão da perda visual em olhos com DMRI, em sua forma intermediária, é a suplementação diária com antioxidantes e zinco(18). A fotocoagulação a laser pode preservar a visão, em alguns casos. O estudo americano "Macular Photocoagulation Study Group" considerou o laser de argônio benéfico em certos casos(19). A terapia fotodinâmica (PDT) tem se mostrado segura e eficaz em algumas formas ativas, principalmente nas formas clássicas, atuando, entretanto, apenas sobre a perda de visão, sem ganho de acuidade visual(20). Há controvérsia ainda sobre a duração da eficácia deste tratamento no longo prazo. As alternativas cirúrgicas para tratamento da MNSR incluem a sua remoção cirúrgica (hoje restrita a raros casos) e a translocação macular, com risco, de complicações, como proliferação vitreo-retiniana (PVR) e a hipotonia, que desestimulam o emprego da técnica(21). Nehemy et al.(22) citam a termoterapia transpupilar TTT como mais uma alternativa terapêutica. Sabe-se da participação efetiva de fatores angiogênicos no desenvolvimento da MNSR, e um dos campos mais promissores no controle da doença, é o emprego dos antiangiogênicos. Diversas drogas antiangiogênicas estão sendo investigadas, mas nenhuma está disponível para uso clínico. Não há tratamento eficaz disponível para as formas avançadas de DMRI como cicatriz disciforme ou atrofia geográfica.
B. 1. c - Outras doenças degenerativas
A síndrome de Usher, associação de RP com surdez parcial ou total, é o resultado da manifestação de um gene autossômico recessivo e pleiotrófico. A incidência da síndrome de Usher gira em torno de três casos por 100.000 habitantes. É a causa mais freqüente de cegueira-surdez em adultos(23). Outra degeneração retiniana tida como causa de cegueira é a coroideremia, distrofia retiniana hereditária, ligada ao sexo, caracterizada por nictalopia simétrica e bilateral, constrição do campo visual periférico e perda da visão central. Exames histopatológico de olhos com coroideremia avançada revelaram atrofia coroidiana avançada as coróide e do EPR, ausência de vasos coróideos e retina em contato direto com a esclera(24). A doença se anuncia com alterações pigmentarias e atrofia do EPR na região do equador. Em estágios avançados ocorre atrofia coriorretiniana difusa com perda significativa da acuidade visual.
COMPENSAÇÃO DA CEGUEIRA POR PRÓTESES VISUAIS ELETRÔNICAS
A - Revisão histórica dos experimentos iniciais de estimulação visual em pacientes cegos
Na tentativa de estimulação elétrica visual vêm sendo feitos experimentos desde a descoberta da eletricidade no século XVIII. Alguns, sem objetivos terapêuticos, foram feitos em animais, sem maiores repercussões(25). O físico e químico francês Le Roy foi o primeiro a descrever, em 1755, a obtenção de fosfenos após estimulação elétrica, na tentativa de corrigir a perda visual em um humano cego(26). Chama-se de fosfenos a percepção de manchas ou pontos de luz após estimulação elétrica ou magnética da via visual. Meyer-Schwickerath e Magnus, em 1951(27), foram os primeiros a estabelecer correlação entre a freqüência e energia da estimulação elétrica e as características dos fosfenos. Em 1969, Pots et al(28), estimularam a córnea com eletrodos, obtendo correspondência através de avaliação cortical, resultados que foram confirmados por Hirose et al, 1977(29).
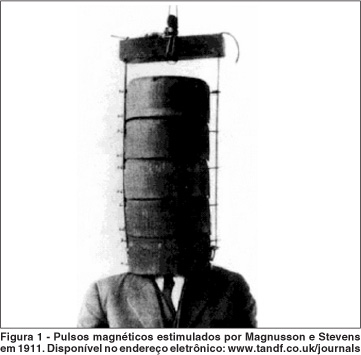
No fim do século XIX, D´Arsonval e Thompson registraram fosfenos substituindo o estímulo de eletricidade por campos eletromagnéticos(30-31) e, em 1911, Magnusson e Stevens(32) estabeleceram alterações na intensidade de fosfenos aumentando a freqüência do estímulo eletromagnético (Figura 1). Esta técnica foi abandonada, depois de várias tentativas para criar percepção de fosfenos com campos eletromagnéticos realizadas no século XX, não se obtendo nenhuma imagem definitiva(33-34).
B - O uso de energia elétrica para criação de implantes eletrônicos visuais
Nas últimas décadas, os avanços científicos em microtecnologia, biotecnologia, eletrônica de computadores e cirurgia vítreo-retiniana têm encorajado os cientistas a desenvolver um implante eletrônico visual para restabelecimento da visão em cegos(35).
Em 1995 teve início um grande projeto financiado pelo governo alemão, englobando dois grupos (Epi-ret e Sub-ret), voltado para o desenvolvimento de programas de pesquisa com implantes sub e epi-retinianos. Vinculado a 12 universidades alemãs, o Projeto Implante de Retina era desenvolvido por engenheiros, médicos oftalmologistas e neurofísicos. No ano 2000, esse projeto foi reorganizado em quatro grupos Epi-ret, Sub-ret, Fisiologia e Biocompatibilidade e aos investimentos do governo alemão somaram-se investimentos da iniciativa privada.
Nos Estados Unidos, três grandes grupos estão trabalhando no desenvolvimento de implantes eletrônicos visuais, sob a coordenação de Humayun, Rizzo, e Chow. Um grupo japonês pesquisa atualmente uma forma modificada de implante de retina chamada implante híbrido. Um grupo belga iniciou há vários anos um programa para desenvolver um implante de nervo óptico sob coordenação de Veraart. Implantes corticais estão sendo pesquisados por dois grupos nos Estados Unidos e um na Suíça. O quadro 1 lista os diversos grupos que trabalham, no mundo, com implantes eletrônicos visuais e seus respectivos coordenadores.
As conquistas mostram várias situações em que dispositivos elétricos podem melhorar a função de um tecido lesado, como implantes cocleares ou marca-passos cardíacos. Implantes cocleares já são uma realidade para o surdo, facilitando-lhe até mesmo a conversação telefônica. A complexidade da estrutura do olho tem dificultado o avanço das pesquisas, já que 130 milhões de fotorreceptores estão envolvidos na tarefa de transformar a luz em energia elétrica e enviar essa informação elétrica detalhada da retina, através de 1,2 milhões de axônios altamente especializados como as células ganglionares que, por sua vez, levam o impulso luminoso ao córtex visual.
Um ponto crucial no sucesso de um implante eletrônico é a garantia de que uma estimulação elétrica de qualquer parte do sistema visual possa criar percepção luminosa. Já está demonstrado que a estimulação elétrica em uma parte do sistema visual resulta em percepção luminosa e no surgimento de fosfenos(36-40).
Outro ponto importante consiste em saber se a estimulação de áreas pequenas de tecido neuronal pode criar alguma imagem, e saber quantos pixels são necessários para o surgimento da imagem. Os pesquisadores devem ainda definir os parâmetros elétricos para a segurança e efetividade de um pixel. Alguns estudos mostraram que 625 pixels podem ser a estimulação mínima para criação de uma imagem simples(41). A eficácia da estimulação elétrica nos tecidos pode ser influenciada pela propriedade elétrica da célula alvo, pela distância dos eletrodos até a célula alvo, impedância dos tecidos, relação entre os limiares de corrente elétrica, pela duração da ativação neuronal e pela influência de estímulos repetitivos na via visual(42-44).
Situações específicas indicam a localização dos implantes eletrônicos. Os implantes retinianos devem beneficiar pacientes com cegueira secundária a doenças degenerativas da camada externa retiniana, como DMRI, RP e coroideremia. Os mesmos implantes retinianos não seriam indicados para pacientes com retinopatia diabética, por exemplo, porque a maioria das camadas da retina, incluindo os axônios das células ganglionares, estão lesadas. Implantes de nervo óptico também necessitariam de axônios das células ganglionares intactos, sendo indicados para o mesmo grupo de pacientes dos implantes retinianos. Implantes corticais seriam válidos para pacientes com cegueira em nível retiniano, no nervo óptico, e até mesmo alguns casos de cegueira cortical.
C - Correção da visão com dispositivos eletrônicos no nível do nervo óptico e córtex visual
C. 1 - Implantes eletrônicos visuais no córtex cerebral
Uma vez que a cegueira tenha ocorrido no nível de células retinianas ou fibras do nervo óptico, a abordagem está restrita ao nível do córtex cerebral. Implantes do córtex cerebral ultrapassam todos os neurônios danificados do sistema visual, e têm potencial para restabelecer a visão de um maior número de pacientes.
Esta abordagem apresenta, entretanto, dificuldades relacionadas com a complexa organização espacial no nível das áreas 17 e 18 do córtex visual, onde dois loci adjacentes não correspondem a duas áreas adjacentes no espaço. Cada pequena área do córtex é altamente especializada para cor, movimento, preferência visual e outros parâmetros visuais. A estimulação elétrica de certo padrão em diferentes regiões do córtex dificilmente produziria percepção similar, e é difícil a obtenção de percepções simples quando estimuladas pequenas quantidades de neurônios.
A cirurgia para implante de prótese cortical traz ainda risco de complicações neurocirúrgicas, com sérias conseqüências em pacientes previamente saudáveis, até mesmo levando ao óbito. Foram observadas manifestações de dor e reações epilépticas em experimentos de implantes corticais(44).
Implantes eletrônicos corticais podem ser colocados dentro do córtex cerebral ou na sua superfície. A microestimulação intracortical, quando comparada à estimulação da superfície cortical, apresenta necessidade de menor limiar de corrente elétrica, geração de formas mais precisas de fosfenos, oportunidade para o aumento do número de eletrodos, e menor necessidade de energia elétrica. Por outro lado, nos implantes de superfície cortical o crânio pode proteger o córtex(44).
A estimulação do córtex visual produzindo a clara percepção de fosfenos em pacientes cegos foi descrita, inicialmente, por Foerster, em 1929(36). Em 1968, Brindley e Lewin, criaram um sistema de prótese visual para ser implantada na superfície cortical, implantando eletrodos no córtex occipital em alguns voluntários cegos. Cabos conectados com cada eletrodo por um sistema de rádio freqüência eram apoiados no crânio, sistema que tornou os pacientes capazes de ver fosfenos em diferentes posições do campo visual, demonstrando que muitos dos eletrodos estavam funcionantes(37).
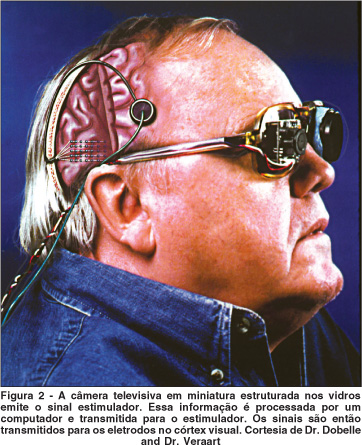
Dobelle et al em 1994, conduziram experimentos corticais, inicialmente em pacientes não cegos, conseguindo a indução de cores e alterações de intensidade dos fosfenos em resposta a diferentes impulsos elétricos(45). Em experimentos subseqüentes, foram utilizados eletrodos em 64 discos de platina na superfície do córtex occipital em pacientes cegos, conectados a uma câmera que consistia de 100x100 dispositivos de fototransitor eletrônico, estimulada com a emissão de letras corridas. Essa prótese permitiu que aqueles pacientes cegos reconhecessem caracteres de seis polegadas, a cinco pés de distância, o que representa uma acuidade visual aproximada de 6/360. Recentemente, Dobelle descreveu resultados observados em longo prazo da utilização de um sistema de visão artificial portátil baseado em estimulação eletrocortical sub-dural com 64 eletrodos. Um voluntário, cego por mais de 20 anos, percebeu fosfenos localizados, foi capaz de localizar visualmente objetos e pôde até contar os dedos de uma mão(46) (Figura 2).
Schmidt et al. foram os primeiros a utilizar a penetração intracortical de eletrodos para aprimorar a resolução espacial, alcançando uma acuidade cinco vezes maior do que com a estimulação superficial. Foram implantados 38 eletrodos intracorticais com um diâmetro de 37,5 µm e altura de 2 µm em um paciente cego por glaucoma durante 22 anos. Foram percebidos fosfenos amarelos, azuis, vermelhos e brancos, em percepções estáveis, sem interferência, correspondendo cada fosfeno à estimulação do eletrodo(47).
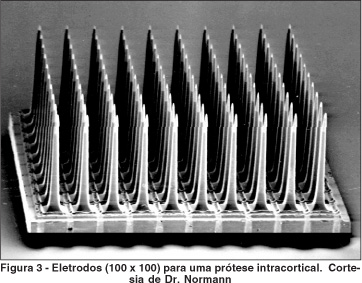
Um novo conceito de microeletrodo cortical foi descrito por Normann et al.(48-49), que implantaram intracorticalmente 100 eletrodos de 1,5 µm de altura a uma distância de 400 micrômetros um do outro. Foram criados fosfenos com energia de 1,9 µA. Os riscos de traumas de uma prótese cortical foram minimizados pela introdução do sistema de eletrodo pneumaticamente, a uma velocidade de 8,3 m/s. Devido à localização intracortical, foi alcançada uma amplitude baixa e, conseqüentemente, uma estimulação de alta definição (Figura 3).
C. 2 - Implantes eletrônicos do nervo óptico
O nervo óptico está sendo pesquisado como estrutura alvo de um implante visual. No entanto, 1,2 milhões de axônios coexistem, em alta densidade, em um diâmetro de 2 milímetros, o que torna essa abordagem tecnicamente difícil, na tentativa de que um estímulo localizado crie percepções detalhadas. Ademais, para atingir o nervo óptico, devem ser dissecadas fibras da dura-máter, gerando risco de infecção do sistema nervoso central ou distúrbio na circulação sangüínea do nervo óptico.
Shandurina, Lyskow(50) e também Veraart et al.(51), relataram criação de fosfenos após estimulação do nervo óptico. O grupo belga liderado por Veraart desenvolveu um eletrodo em espiral envolvendo o nervo óptico com quatro contatos elétricos, que foram implantados em um paciente de 59 anos cego por RP. Estímulos elétricos no nervo óptico produziram fosfenos localizados e coloridos, que foram amplamente distribuídos através do campo visual. Os resultados foram reproduzidos, de forma semelhante, durante 118 dias, e não houve complicações pós-operatórias(44) (Figura 4).
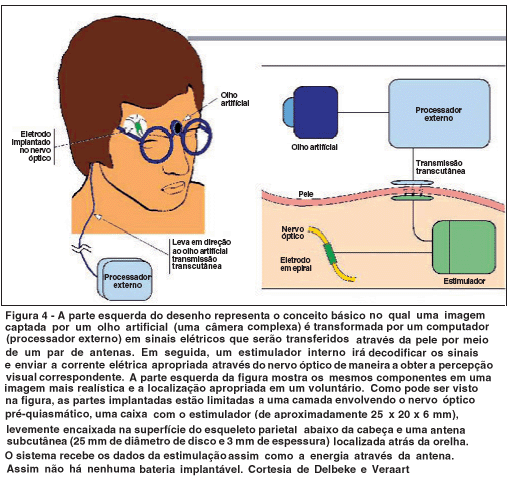
D - Restabelecimento de percepção visual em cegos com prótese retiniana
As pesquisas dos implantes retinianos objetivam o desenvolvimento de próteses que estimulem diretamente componentes neuronais do sistema visual para promover alguma percepção visual útil em pacientes cegos por doenças degenerativas retinianas(52-65). Pacientes portadores de RP apresentam grande perda visual, o que os torna bons candidatos para uma prótese retiniana, por lhes ser útil qualquer melhora significativa na visão. Pacientes em estado avançado de degeneração macular, inclusive a relacionada à idade, podem também ser beneficiados por uma prótese retiniana(10). Entretanto, fazem-se necessários mais estudos para garantir a preservação da visão periférica presente em pacientes com degeneração macular, diante das agressões do procedimento cirúrgico e dos efeitos do implante retiniano.
Os implantes de retina exigem que o paciente tenha o sistema visual intacto, desde o nervo óptico até o cérebro, e visam, principalmente, devolver visão suficiente para deambulação, uma vez que por enquanto ainda não há perspectiva de criação de um implante que permita tarefas complexas e detalhadas como leitura.
A primeira evidência de que pessoas cegas percebem fosfenos em resposta à estimulação ocular, feita eletricamente, ocorreu no fim dos anos sessenta(28) e testes subseqüentes provaram o eliciamento de respostas evocadas eletricamente após estimulação retiniana. Outros mostraram que pacientes cegos com RP tiveram percepção visual com resolução espacial após estimulação elétrica local da parte interna da superfície retiniana. Um dos pacientes submetidos à prova apresentava ausência de percepção luminosa e atingiu uma resolução de 1,75 graus (6/300)(66). Ressalta-se, entretanto, que a maioria dos pacientes necessitaram de um nível de estimulação que se aproxima de ou excede os limites de segurança dos tecidos aceitos para uso por tempo prolongado. Foram feitas estimulações epirretinianas agudas, com duração de seis a oito horas, em primatas, para se estudar os efeitos da estimulação elétrica, conseguindo-se resultados compatíveis com os estímulos(67).
Os implantes epirretiniano e sub-retiniano, atualmente em estudo, apresentam vantagens mecânicas e biológicas, entretanto, ainda enfrentam o desafio de desenvolverem um sofisticado estimulador eletrônico eficiente e de baixa tensão. Ainda não se sabe qual a melhor localização para a melhor percepção, com a carga elétrica mais baixa para estimular os neurônios, e tendo, ainda, maior biocompatibilidade. O implante epirretiniano deve receber estímulos de uma câmera e de uma unidade de processamento. A mensagem visual da unidade de processamento leva à construção de um gradiente eletrônico (e uma imagem subseqüente) no implante epirretiniano, que estimula as células ganglionares e o sistema visual próximos. Nos estudos da prótese sub-retiniana, microfotodiodos sensíveis à luz, acoplados a microeletrodos, são implantados entre o EPR e a camada externa da retina. Os estímulos luminosos na retina geram correntes nos fotodiodos que ativam os microeletrodos que, por sua vez, estimulam os neurônios sensoriais retinianos, para gerar o funcionamento retiniano.
D. 1 - Implantes epirretinianos
As células ganglionares se localizam abaixo da superfície retiniana interna e da membrana limitante interna e estão densamente agrupadas, com apenas uma camada de células na maioria da superfície retiniana. Foram encontradas em humanos até 18 tipos de células ganglionares, e a compreensão do seu funcionamento irá aos poucos facilitar o desenvolvimento de uma prótese visual.
Stone et al. foram os primeiros a demonstrar quantidade considerável de células ganglionares saudáveis presentes em casos de RP(68). Posteriormente, a análise da retina de pacientes com RP em estágio avançado revelou que as células da camada nuclear interna, principalmente células bipolares (78,4%) e ganglionares (29,7%), estão relativamente intactas em comparação com a pequena quantidade presente de células nucleares externas e de fotorreceptores (4,9%)(69-70). Estudos histológicos mostraram padrão semelhante de lesão na DMRI onde as células da camada nuclear externa estavam razoavelmente atenuadas, enquanto que as células ganglionares e nucleares da camada interna estavam relativamente preservadas(71).
A presença de uma camada de células e/ou fibras nervosas na parte interna retiniana prediz a viabilidade de uma prótese epirretiniana. Os implantes epirretinianos devem estimular uma ou mais células da parte interna da retina (células ganglionares, camadas de fibras nervosas, ou células nucleares internas). Ainda não se sabe, entretanto, quais células da camada interna retiniana serão estimuladas. Testes em humanos apontaram as células nucleares internas como as mais provavelmente ativadas por estímulos elétricos locais(72). Outros realizaram estimulação de pacientes com RP após bloqueio de transmissão sináptica mediado por aspartato. A seguir, foi feita estimulação retiniana com implantes epirretinianos, obtendo-se potenciais corticais elétricos compatíveis com uma estimulação elétrica da camada nuclear interna(55). Uma vantagem da abordagem epirretiniana decorre de a relação topográfica das células ganglionares em relação aos fotorreceptores e às coordenadas do campo visual serem razoavelmente direta na retina.
Os núcleos das células ganglionares estão mapeados na retina em uma correlação proporcional ao campo visual contralateral, e a percepção visual, após estimulação, deve ser de pequenos pontos focais. Em contraposição, os axônios dessas células situam-se sobre as células ganglionares e sua estimulação resultaria em uma imagem em arco. Estudos sugerem que uma estimulação em pulso de duração de pelo menos 0,5 msec ativará células retinianas mais profundas, como as bipolares(44). Ainda não se sabe se, com esse mínimo de energia elétrica, as células parvocelulares ou as magnocelulares serão ativadas e se impulsos elétricos em grupos, ou isolados, serão mais eficazes(73). A intensidade do estímulo a ser usado pode ser influenciada pela distância do implante para retina.
Até o momento, a maioria das informações sobre implantes retinianos advêm de pesquisa em animais. Embora os primatas ou macacos sejam os modelos mais perfeitos, as barreiras éticas e os custos limitam o seu uso. Sendo a via óptica dos gatos muito similar à dos humanos e já bastante estudada durante várias décadas, são os mesmos considerados como segunda opção de modelos experimentais para provar a funcionalidade de um implante retiniano(74), já havendo sido comprovada naqueles animais a ativação cortical retinotópica(40,57).
O nosso grupo, vinculado à Universidade de Marburg, realiza há oito anos experimentos que usam gatos como modelo de investigação para implantes epirretinianos. Grupo multidisciplinar, com participação de engenheiros, neurofísicos e oftalmologistas, utiliza complexo laboratório com programas de computadores, de física e de engenharia eletrônica para pesquisa da funcionabilidade de uma prótese epirretiniana. Inicialmente é realizada craniotomia em gatos sob narcose, posicionando-se eletrodos corticais (5 a 18) nas áreas V1 e V2. Em seguida, são posicionados eletrodos (7 a 15) ou implantes epirretinianos na região paramacular, permitindo que sejam captados pelos eletrodos corticais os estímulos elétricos epiretinianos de 100 a 400 µs de duração e 100 µA de amplitude. Com este método, já foram definidos parâmetros de estímulo elétrico e, após experimentos de curta duração (de até 7 dias), chegou-se à conclusão de que há uma chance real de que um implante epirretiniano funcione, uma vez que foi obtida uma visão de 1 a 5 graus de ângulo(40,56-57). No entanto, tais resultados ainda não foram reproduzidos em experimentos com implantes de longa duração, por ausência de biocompatibilidade e de adequada fixação epirretiniana(75). Foram realizados outros experimentos para avaliar a eficácia de eletrodos subdurais em caninos, levando à conclusão de que esse método é eficaz para pesquisa naqueles animais(76).
O estabelecimento de contato estável entre um implante epirretiniano e a superfície retiniana apresenta vários desafios. Duas forças diferentes, surgindo de aceleração angular durante a rotação ocular (a inércia do próprio implante e o movimento de fluidos atraídos pelo implante) poderiam deslocar ou danificar o implante epirretiniano e lesar a retina. Ademais, o implante epirretiniano deve ser suficientemente pequeno e fino para permanecer aderido à superfície interna retiniana sem comprimi-las excessivamente. Uma abordagem epirretiniana também leva consigo o risco de induzir reações destrutivas das células de Müller, que poderiam, entre outras coisas, formar membranas epirretinianas, ou proliferações celulares e conseqüente PVR, aumentando o risco de perda visual por phthisis bulbi, por exemplo. Essas membranas epirretinianas podem ainda agir como barreira à resistência elétrica dos eletrodos.
Para se conseguir um contato entre o eletrodo e a superfície interna da retina, é obrigatória a remoção completa da interface vítreo-retiniana, que é uma camada composta por tecido conjuntivo, situada entre a retina e o vítreo. Após vitrectomia via pars plana, restos de vítreo nessa interface poderiam impedir um contato íntimo implante-retina(56). A remoção da interface vítreo-retiniana pode ser alcançada de formas mecânica ou bioquímica. A forma mecânica é realizada de rotina por cirurgiões vítreo-retinianos, utilizando a ponteira do vitreótomo com cânula de aspiração ativa (flauta) durante a cirurgia. O uso de corante como indocianina verde ou azul de tripano poderia auxiliar na visibilidade e remoção completa do vítreo(77-78). A forma de remoção bioquímica da interface vítrea depende do uso de enzimas que estão sendo testadas, ainda sem eficácia comprovada, para causar vitreólise (colagenases ou hialuronidase), ou sinérese do vítreo (dispase, plasmin, tPA, uroquinase)(79-80).
Tecnicamente, a fixação dos implantes epirretinianos continua sendo um dos maiores desafios da abordagem epirretiniana. Fixar um dispositivo eletrônico a um tecido biológico é muito difícil. O implante deve reter sua própria estrutura; manter-se estável não somente em olhos saudáveis, mas também em olhos afácicos e vitrectomizados. Até o momento não há consenso sobre a técnica de fixação mais adequada para a abordagem epirretiniana. Tem sido testado intensamente o uso de tacks, pequenas estruturas compostas de titânio ou hidrogel, para a fixação dos implantes epirretinianos(81). O uso de tacks na cirurgia oftalmológica vem sendo testado de longa data, inicialmente na fixação da retina em casos de descolamento com ruptura gigante e/ou PVR. Os resultados foram desapontadores, uma vez que uma grande parte dos olhos desenvolveu uma forma mais agressiva de PVR progredindo até phthisis bulbi(82). Para a fixação de implantes epirretinianos poderia ser utilizada a sutura nas estruturas intra-oculares, o que está associado a riscos de lesão dos tecidos(75). Outra opção seria o uso de colas biológicas ou fatores de crescimento. Após fracasso na tentativa de utilização de cola(56,75), o nosso grupo de pesquisadores da Universidade de Marburg está avaliando uma técnica que une sutura intra-ocular e fixação bioquímica, com resultados preliminares animadores.
Vários modelos diferentes de implantes epirretinianos têm sido testados em animais. Os trabalhos iniciais com implantes epirretinianos inativos objetivavam a avaliação da sua biocompatibilidade(53,55-56). Eram implantes compostos de silicone, poli-imida, ou platina. Atualmente, a maioria dos grupos desenvolve implantes muito mais complexos (Figura 5), em que a primeira parte é um dispositivo eletrônico contendo os componentes de transferência e recepção de energia e sinais, envolvidos por uma camada de silicone, aproximando-se do formato de uma lente intra-ocular. A segunda parte é um microcabo flexível, que transporta os impulsos eletrônicos até a terceira parte, um fino microeletrodo (array) posicionado em contato com a superfície retiniana.
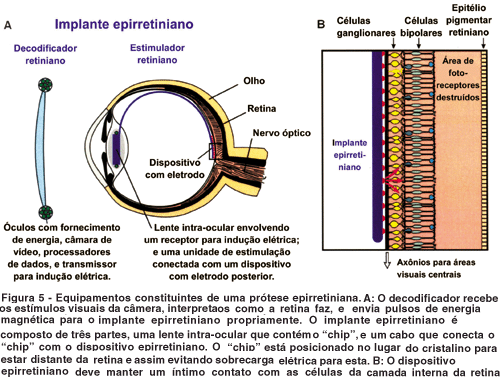
A construção desses protótipos e sua divisão em três partes se deve à necessidade de manutenção dos componentes eletrônicos no meio do globo ocular, isolados na cavidade vítrea por seu conteúdo líquido. O líquido no vítreo funciona com um dissipador de calor, dissipando a energia produzida pelo implante de retina. Experimentos conclusivos demonstram que a retina não suporta mais que 50 mW de energia por 1,4 mm2 de área. Em contraste, 500 mW de energia na região central do corpo vítreo se mostrou extremamente segura(83).
Novos estudos com implantes ativos visam avaliar a possibilidade de uma estimulação retiniana de longa duração, levando ao estabelecimento de uma técnica cirúrgica padrão para implantação(55-56,67,84).
Além do implante intra-ocular, uma prótese visual epirretiniana foi projetada para conter mais dois componentes: uma pequena câmera ou sensor, que deve ser posicionada na parte externa do olho, possivelmente acoplada a um par de óculos, para captar imagem do meio ambiente; e um decodificador eletrônico retiniano, também extra-ocular. O decodificador recebe a cena visual obtida pela câmera, calcula tempo e amplitude dos sinais e transforma-os em sinais elétricos, como a própria retina o faz, enviando os impulsos, através de ondas eletromagnéticas, ao implante retiniano intra-ocular.
Um novo conceito de estimulação epirretiniana surgiu recentemente, pelo qual dispositivos epirretinianos liberariam constantemente formas inativas de neurotransmissores que, ativados sob estimulação luminosa do meio ambiente, gerariam impulsos elétricos epirretinianos(85-86).
D. 2 - Implantes sub-retinianos
Várias equipes pesquisam, hoje, no mundo, os implantes sub-retinianos(87-89), que consistem de milhares de microfotodiodos sensíveis à luz implantados entre o epitélio pigmentar e a camada externa da retina (Figura 6). A luz estimula esses fotodiodos que, por sua vez, enviam estímulos elétricos, desencadeando impulsos em todas as camadas da retina, até o nervo óptico. A técnica sub-retiniana teoricamente seria a mais fisiológica de todos os implantes estudados, atuando no início da via óptica, o que permite que o estímulo se inicie no primeiro neurônio. Registram-se publicações demonstrando que a introdução de implantes sub-retinianos pode ser feita por duas vias cirúrgicas: acesso pelo corpo vítreo por vitrectomia via pars plana, ou diretamente no espaço sub-retiniano através de incisão escleral externa(88-89).
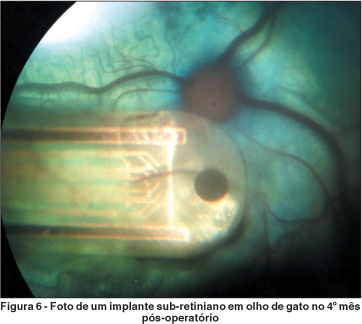
Há vantagens na abordagem sub-retiniana, quando o dispositivo para implante sub-retiniano pode ser "energizado" somente com luz incidente do meio externo, de forma menos complexa. Nesse caso, não seria necessária câmara externa, podendo-se utilizar os movimentos oculares para a localização de objetos. Outra vantagem é a facilidade de posicionamento cirúrgico dos microfotodiodos, pois o EPR mantém seco o espaço sub-retiniano deixando o implante livre naquele espaço.
A abordagem sub-retiniana não está, entretanto, livre de desafios e problemas. Experimentos in vivo mostraram que talvez a luz do meio ambiente não seja suficiente para estimular microfotodiodos, exigindo o desenvolvimento de um dispositivo externo para tanto(5). Um implante sub-retiniano pode impedir difusão de nutrientes do EPR por barreira mecânica, podendo causar fibrose sub-retiniana crônica, proliferação e migração de células do epitélio pigmentar da retina com destruição retiniana de várias intensidades. Ademais, microfotodiodos sub-retinianos, localizados sobre as células horizontais, e as extensões longas horizontais destas células poderiam interferir na transferência do estímulo visual para o implante. Alguns estudos histológicos revelaram pequena proliferação de células nucleares internas e ganglionares, sem que nenhuma resposta inflamatória ocorra envolvendo o implante sub-retiniano(88).
CONCLUSÕES E DESAFIOS
Aparelhos microeletrônicos não devem ser obstáculos para o desenvolvimento de uma prótese clinicamente eficaz. Considerando as estruturas da retina, cientistas devem desenvolver a melhor forma de fazer a comunicação entre o aparelho eletrônico e o tecido neural retiniano. Futuramente, deve ser alcançada uma biocompatibilidade maior na interface retina-eletrônica, incluindo a demonstração de que o nível de carga elétrica necessária para a ativação neuronal esteja dentro dos padrões aceitos para uma estimulação duradoura. Deve-se buscar uma técnica cirúrgica segura para o implante do aparelho microeletrônico. Nos últimos 30 anos, cirurgias do cristalino e vítreo-retinianas vêm sendo utilizadas na prática clínica, e muitas doenças sem perspectiva de tratamento no passado recente estão sendo beneficiadas por esses procedimentos. As pesquisas atuais devem utilizar esses conhecimentos cirúrgicos anteriores e atuais, para implantar a prótese retiniana no olho, ajustando a biocompatibilidade e minimizando as complicações(35).
A pesquisa que busca a criação de uma prótese eletrônica eficaz para o cego dá inicio a uma fase de pequenos testes pilotos em humanos. Humayun et al., descreveram, recentemente, a implantação de uma prótese epirretiniana em humanos(90). Chow et al. implantaram prótese sub-retiniana em alguns indivíduos cegos, com resultados animadores(91). Estão previstos para 2004, na Alemanha, testes em um pequeno número de indivíduos cegos, com ausência de percepção luminosa por RP, implantando uma complexa prótese epirretiniana. Paralelamente, continuam os testes em animais, buscando melhorar a tecnologia utilizada para esse tratamento e procurando elucidar algumas questões ainda abertas.
AGRADECIMENTOS
Eduardo B. Rodrigues agradece o apoio do governo alemão (Serviço Alemão de Intercâmbio Acadêmico, DAAD); e da Fundação Fehr. Os autores reconhecem aqui a importância dos companheiros do grupo Epi-Ret e agradecem a sua cooperação no projeto, com destaque para os Professores Eckhorn e Andreas Rentzos. O grupo Epi-ret em Marburg tem o suporte do Ministério de Ciência e Tecnologia da Alemanha (BMBF).
Os autores agradecem também a gentil participação dos colegas: Dr. Delbeke e Dr. Veraart, do Laboratório de Engenharia e Reabilitação Neural, grupo MIVIP, Université Catholique de Louvain, Brussels, Bélgica; Dr. Bill Dobelle, Instituto Dobelle, Suíça; Dr. Normann, Centro para Interfaces Neurais, Departamento de Bioengenharia, Universidade de Utah, USA, que forneceram algumas figuras ilustrativas para este artigo, como cortesia.
REFERÊNCIAS
1. Bicas HEA, Ávila MP. Visão artificial. Arq Bras Oftalmol 2002;65:505-7.
2. Krumpazsky HG, Klauss V. Epidemiology of blindness and eye disease. Ophthalmologica 1996;210:1-84.
3. Medina NH, Barros OM, Muñoz EH, Magdaleno RL, Barros AJD, Ramos LH. Morbidade ocular em idosos da cidade de São Paulo - SP, Brasil. Arq Bras Oftalmol 1993;56:276-8.
4. Boelter MC, Azevedo MJ, Gross JL, Lavinsky J. Fatores de risco para retinopatia diabética. Arq Bras Oftalmol 2003;66:239-47.
5. Zrenner E. Will retinal implants restore vision? [published erratum in Science 2002;295:2213]. Science 2002;295:1022-5.
6. Sharma RK, Ehinger B. Management of hereditary retinal degenerations: present status and future directions. Surv Ophthalmol 1999;43:427-44.
7. Paranhos FRL, Nehemy MB, Hirose T. Bilateralidade, simetria e correlação clínico-eletrofisiológica na retinose pigmentar. Arq Bras Oftalmol 1998;61: 386-9.
8. Pasantes-Morales H, Quiroz H, Quesada O. Treatment with taurine, diltiazem, and vitamin E retards the progressive visual field reduction in retinitis pigmentosa: a 3-year follow-up study. Metab Brain Dis 2002;17:183-97.
9. Berson EL. Retinitis pigmentosa: unfolding its mystery. Proc Natl Acad Sci USA 1996;93:4526-8.
10. Acland GM, Aguirre GD, Ray J, Zhang Q, Aleman TS, Cideciyan AV, et al. Gene therapy restores vision in a canine model of childhood blindness. Nat Genet 2001;28:92-5.
11. Berger AS, Tezel TH, Del Priore LV, Kaplan HJ. Photoreceptor transplantation in retinitis pigmentosa: short-term follow-up. Ophthalmology 2003;110: 383-91.
12. Leibowitz HM, Krueger DE, Maunder LR, Milton RC, Kini MM, Kahn HA, et al. The Framingham Eye Study monograph: An ophthalmological and epidemiological study of cataract, glaucoma, diabetic retinopathy, macular degeneration, and visual acuity in a general population of 2631 adults, 1973-1975. VI. Macular degeneration. Surv Ophthalmol 1980;24 Suppl:428-57.
13. Blumenkranz MS, Russell SR, Robey MG, Kott-Blumenkrang R, Penneys N. Risk factors in age-related maculopathy complicated by choroidal neovascularization. Ophthalmology 1986;93:552-8.
14. West SK, Rosenthal FS, Bressler NM, Bressler SB, Munoz B, Fine SL, et al. Exposure to sunlight and other risk factors for age-related macular degeneration. Arch Ophthalmol 1989;107:875-9.
15. Bressler NM, Bressler SB, Fine SL. Age-related macular degeneration. Surv Ophthalmol 1988;32:375-413.
16. Ávila MP. Subretinal neovascularization: contribution on angiographic and therapeutic study of patients with age-related macular degeneration [thesis]. Belo Horizonte; Universidade Federal de Minas Gerais; 1997.
17. Farah ME, Oshima A, Costa RA, Sallum JF. Degeneração macular relacionada à idade: modalidades terapêuticas. Arq Bras Oftalmol 2001;64:583-8.
18. McBee WL, Lindblad AS, Ferris FL. Who should receive oral supplement treatment for age-related macular degeneration? Curr Opin Ophthalmol 2003; 14:159-62.
19. Macular Photocoagulation Study Group. Argon laser photocoagulation for neovascular maculopathy: Three-year results from randomized clinical trials. Arch Ophthalmol 1986;104:694-701.
20. Bressler NM. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: two-year results of 2 randomized clinical trials—tap report 2. Arch Ophthalmol 2001;119:198-207.
21. Aisenbrey S, Lafaut BA, Szurman P, Grisanti S, Luke C, Krott R, et al. Macular translocation with 360 degrees retinotomy for exudative age-related macular degeneration. Arch Ophthalmol 2002;120:451-9.
22. Nehemy M, Campos C, Rodrigues RP, Moraes JG, Passos E. Termoterapia transpupilar para o tratamento de membrana neovascular sub-retiniana oculta secundária à degeneração macular relacionada a idade. Rev Bras Oftalmol 2001;60:171-81.
23. Liarth JCS, Gonçalves EA, Gonçalves JOR, Neiva DM, Leal FAMl. Síndrome de Usher: características clínicas. Arq Bras Oftalmol 2002;65:457-61.
24. Grutzner P, Vogel MH. Clinical course and histological findings in progressive tapeto-choroidal degeneration (choroideremia). Klin Monatsbl Augenheilkd 1973;162:206-17.
25. Watson W. An account of Mr. Benjamin Franklin's treatise, lately published, intitulated "Experiments and observations on electricity, made at Philadelphia in America". Philos Trans R Soc Lond 1751;47:202-11.
26. Le Roy C. Où l´on rend compte de quelques tentatives que l´on a faites pour guérir plusieurs maladies par l´électricité. Hist Acad Roy Sciences (Paris), Mém Math Phys 1755:87-95.
27. Meyer-Schwickerath G, Magnus R. Über Selektive elektrishe Erregbarkeit vershiedener Netzhautanteile. Graefes Arch Clin Ophthalmol 1951;151:701-13.
28. Potts AM, Inoue J. The electrically evoked response (EER) of the visual system II. Effect of adaptation and retinitis pigmentosa. Invest Ophthalmol 1969;8:605-12.
29. Hirose T, Miyake Y, Hara A. The cortical response to electrical stimulation of the retina and its clinical applications. Invest Ophthalmol Vis Sci 1977;16: S131.
30. D´Arsonval MA. Dispositifis pour la mesure des courants alternatifs de toutes fréquences. Comptes Rendus 1896;3:450-1.
31. Thompson SP. A physiological effect of an alternating magnetic field. Proc R Soc Lond (Biol) 1910;82:396-8.
32. Magnusson CE, Stevens HC. Visual sensations produced by changes in the strength of a magnetic field. Am J Physiol 1911;29:124-36.
33. Marg E. Magnetostimulation of vision: direct noninvasive stimulation of the retina and the visual brain. Optom Vis Sci 1991;68: 427-40.
34. Marg E, Rudiak D. Phosphenes induced by magnetic stimulation over the occipital brain: description and probable site of stimulation. Optom Vis Sci 1994;71:301-11.
35. Rizzo JF 3rd, Wyatt J, Humayun M, Juan E, Liu W, Chow A, et al. Retinal prosthesis: an encouraging first decade with major challenges ahead. Ophthalmology 2001;108:13-4.
36. Foerster O. Beitrage zur pathophysiologie der sehbahn und der spehsphare. J Psychol Neurol 1929;39:435-63.
37. Brindley GS, Lewin WS. The sensations produced by electrical stimulation of the visual cortex. J Physiol 1968;196:479-93.
38. Dobelle WH, Mladejovsky MG, Girvin JP. Artificial vision for the blind: Electrical stimulation of visual cortex offers hope for a functional prosthesis. Science 1974;183:440-4.
39. Humayun MS, de Juan E, Weiland JD, Dagnelie G, Katona S, Greenberg R, et al. Pattern electrical stimulation of the human retina. Vision Res 1999;39: 2569-76.
40. Schanze T, Wilms M, Eger M, Hesse L, Eckhorn R. Activation zones in cat visual cortex evoked by electrical retina stimulation. Graefes Arch Clin Exp Ophthalmol 2002;240:947-54.
41. Cha K, Horch K, Normann RA. Simulation of a phosphene based visual field: visual acuity in a pixelized vision system. Ann Biomed Eng 1992;20:439-49.
42. Rattay F. Analysis of the electrical excitation of CNS neurons. IEEE Trans Biomed Eng 1998;45:766-72.
43. Schmidt EM, McIntosh JS. Microstimulation of precentral cortex with chronically implanted microelectrodes. Exp Neurol 1979;63:485-503.
44. Margalit E, Maia M, Weiland JD, Greenberg RJ, Fujii GY, Torres G, et al. Retinal prosthesis for the blind. Surv Ophthalmol 2002;47:335-56.
45. Dobelle WH. Artificial vision for the blind. The summit may be closer than you think. ASAIO J 1994;40:919-22.
46. Dobelle WH. Artificial vision for the blind by connecting a television camera to the visual cortex. ASAIO J 2000;46:3-9.
47. Schmidt EM, Bak MJ, Hambrecht FT, et al. Feasibility of a visual prosthesis for the blind based on intracortical microstimulation of the visual cortex. Brain 1996;119:507-22.
48. Normann RA, Maynard E, Guillory K, Warre D. Cortical implants for the blind. IEEE Spectrum 1996;33:54-9.
49. Normann RA, Maynard EM, Rousche PJ, Warren DJ. A neural interface for a cortical vision prosthesis. Vision Res 1999;39:2577-87.
50. Shandurina AN, Lyskow EB. Evoked potentials to contact electrical stimulation of the optic nerves. Hum Physiol 1986;12:9-16.
51. Veraart C, Raftopoulos C, Mortimer JT, Delbeke J, Pins D, Michaux G, et al. Visual sensations produced by optic nerve stimulation using an implanted selfsizing spiral cuff electrode. Brain Res 1998;813:181-6.
52. Chow AY, Peachey NS. The subretinal microphotodiode array retinal prosthesis [commented on Ophthalmic Res 1999;31:246]. Ophthalmic Res 1998;30: 195-8.
53. Majii AB, Humayun MS, Weiland JD, Suzuki S, D'Anna SA, de Juan E. Long-term histological and electrophysiological results of an inactive epiretinal electrode array implantation in dogs. Invest Ophthalmol Vis Sci 1999;40: 2073-81.
54. Walter P, Szurman P, Vobig M, Berk H, Lüdtke-Handjery HC, Richter H, et al. Successful long-term implantation of electrically inactive epiretinal microelectrode arrays in rabbits. Retina 1999;19:546-52.
55. Walter P, Heimann K. Evoked cortical potentials after electrical stimulation of the inner retina in rabbits. Graefes Arch Clin Exp Ophthalmol 2000;238:315-8.
56. Hesse L, Schanze T, Wilms M, Eger M. Implantation of retina stimulation electrodes and recording of electrical stimulation responses in the visual cortex of the cat. Graefes Arch Clin Exp Ophthalmol 2000;238:840-5.
57. Schanze T, Greve N, Hesse L. Towards the cortical representation of form and motion stimuli generated by a retina implant. Graefes Arch Clin Exp Ophthalmol 2003;241:685-93.
58. Schwahn H, Gekeler F, Kohler K, Kobuch K, Sachs HG, Schulmeyer F, et al. Studies on the feasibility of a subretinal visual prosthesis: data from Yucatan micropig and rabbit. Graefes Arch Clin Exp Ophthalmol 2001;239:961-7.
59. Zrenner E, Miliczek KD, Gabel VP, Graf HG, Guenther E, Haemmerle H, et al. The development of subretinal microphotodiodes for replacement of degenerated photoreceptors [commented on Ophthalmic Res 1998;30:195-8]. Ophthalmic Res 1997;29:269-80.
60. Zrenner E, Stett A, Weiss S, Aramant RB, Guenther E, Kohler K, et al. Can subretinal microphotodiodes successfully replace degenerated photoreceptors? Vision Res 1999;39:2555-67.
61. Zrenner E, Gekeler F, Gabel VP, Graf HG, Graf M, Guenther E, et al. Subretinal microphotodiode arrays as replacement for degenerated photoreceptors? Ophthalmologe 2001;98:357-63.
62. Eckmiller R. Learning retina implants with epiretinal contacts. Ophthalmic Res 1997;29:281–9.
63. Kerdraon YA, Downie JA, Suaning G, Capon MR, Coroneo MT, Lovel NH. Development and surgical implantation of a vision prosthesis model into the ovine eye. Clin Experiment Ophthalmol 2002;30:36-42.
64. Wyatt J, Rizzo JF. Ocular implants for the blind. IEEE Spectrum 1996;112: 47-53.
65. Yagi T, Hayashida Y. Implantation of the artificial retina. Nippon Rinsho 1999;57:1208-15.
66. Humayun MS, de Juan E, Dagnelie G, Greenberg RJ, Props. RH, Phillips DH. Visual perception elicited by electrical stimulation of retina in blind humans. Arch Ophthalmol 1996;114:40-6.
67. Gerding H, Hornig R, Eckmiller R. Implantation, mechanical fixation, and functional testing of epiretinal multimicrocontact arrays (MMA) in primates [abstract]. Invest Ophthamol Vis Sci 2001;42:S814.
68. Stone JL, Barlow WE, Humayun MS, de Juan ER, Milam AH. Morphometric analysis of macular photoreceptors and ganglion cells in retinas with retinitis pigmentosa. Arch Ophthalmol 1992;110:1634-9.
69. Santos A, Humayun MS, de Juan E, Greenburg RJ, Marsh MJ, Klock IB, et al. Preservation of the inner retina in retinitis pigmentosa: A morphometric analysis. Arch Ophthalmol 1997;115:511-5.
70. Humayun MS, Prince M, de Juan E, Barron Y, Moskowitz M, Klock IB, et al. Morphometric analysis of the extramacular retina from postmortem eyes with retinitis pigmentosa. Invest Ophthalmol Vis Sci 1999;40:143-8.
71. Kim SY, Sadda S, Pearlman J, Humayun MS, de Juan E, Melia BM, et al. Morphometric analysis of the macula in eyes with disciform age-related macular degeneration. Retina 2002;22:471-7.
72. Weiland JD, Humayun MS, Dagnelie G, de Juan E, Greenberg RJ, Iliff NT. Understanding the origin of visual percepts elicited by electrical stimulation of the human retina. Graefes Arch Clin Exp Ophthalmol 1999;237:1007-13.
73. Eckhorn R, Stett A, Schanze T, Gekeler F, Schwahn H, Zrenner E, et al. Physiological functional evaluation of retinal implants in animal models. Ophthalmologe 2001;98:369-75.
74. Campbell FP. The eye of the cat in ophthalmic research. Arch Ophthalmol 1961;4:35-46.
75. Rodrigues EB, Schanze T, Rentzos A, Hesse L. Ophthalmic challenges in the development of an epiretinal prosthesis. Ophthalmic Research. In press.
76. Margalit E, Weiland JD, Clatterbuck RE, Fuji GY, Maia M, Tameesh M, et al. Visual and electrical evoked response recorded from subdural electrodes implanted above the visual cortex in normal dogs under two methods of anesthesia. J Neurosci Methods 2003;123:129-37.
77. Rodrigues EB, Meyer CH, Kroll P. Intravitreal staining of retinal internal limiting membrane using indocyanine green. Surv Ophthalmol. In press.
78. Rodrigues EB, Meyer CH, Schmidt JC, Kroll P. Trypan blue stains the epiretinal membrane but not the internal limiting membrane [commented on Br J Ophthalmol 2003;87:216-9]. Br J Ophthalmol 2003;87:1431-2.
79. Hesse L. Using enzymes in the posterior eye segment. Current status and future possibilities. Ophthalmologe 2001;98:1176-80.
80. Salum JMF, Belfort R. Fator tecidual ativador de plasminogênio (rt-PA) em oftalmologia: casos clínicos. Arq Bras Oftalmol 1997;60:88-91.
81. Lakhanpal RR, Yanai D, Weiland JD, Fujii GY, Caffey S, Greenberg RJ, et al. Advances in the development of visual prostheses. Curr Opin Ophthalmol 2003;14:122-7.
82. de Juan E Jr., Hickingbotham D, Machemer R. Retinal tacks. Am J Ophthalmol 1985;99:272-4.
83. Piyathaisere DV, Margalit E, Chen SJ, Shyu JS, D'Anna SA, Weiland JD, et al. Heat effects on the retina. Ophthalmic Surg Lasers Imaging 2003;34: 114-20.
84. Vobig MA, Walter P, Berk H, Heimann K. Combined anterior and posterior segment procedure for implantation of a complex retinal prosthesis[abstract]. Invest Ophthalmol Vis Sci 1999;40:S733.
85. Lezzi R, Fishman HA. Visual prosthesis use neurotransmitter retinal chips to stimulate retinal function. Eurotimes 2002;7:1-5.
86. Peterman MC, Bloom DM, Lee C, Bent SF, Marmor MF, Blumenkranz MS, t al. Localized neurotransmitter release for use in a prototype retinal interface. Invest Ophthalmol Vis Sci 2003;44:3144-9.
87. Peachey NS, Chow AY. Subretinal implantation of semiconductor-based photodiodes: progress and challenges. J Rehabil Res Dev 1999;36:371-6.
88. Peyman G, Chow AY, Liang C, Chow VY, Perlman JI, Peachey NS. Subretinal semiconductor microphotodiode array. Ophthalmic Surg Lasers 1998;29:234-41.
89. Taneri S, Bollman FB, Uhlig CE, et al. In vitro and in vivo testing of different tack-types for intraocular fixation if retina implants [abstract]. Invest Ophthalmol Vis Sci 1999;40:S733.
90. Humayun MS, Weiland JD, Fujii GY, Greenberg R, Williamson R, Little J, et al. Visual perception in a blind subject with a chronic microelectronic retinal prosthesis. Vision Res 2003;43:2573-81.
91. Chow AY, Packo KH, Pollack JS, Schuchard RA. Subretinal artificial silicon retina microchip implantation in retinitis pigmentosa patients: long-term follow-up [abstract]. Invest Ophthalmol Vis Sci 2003;44:4205.
Endereço para correspondência
Eduardo B. Rodrigues
Robert-Koch Strasse 4, 35037
Marburg, Alemanha
E-mail: [email protected]
Fontes de Auxílio à Pesquisa: Eduardo B. Rodrigues recebe o suporte do DAAD (German Academic Exchange Service) "grant": A/01/16770; e da Fundação Fehr. O grupo Epi-Ret recebe investimento para pesquisa do BMBF (German Ministry for Science and Education), "grants" 01 IN 501 F e 01 KP 0006.