

Emerson Kenji Oyamaguchi1; Daniel Rocha Lucena1; Isolda P. de Negreiros Nogueira Madur2; Rodrigo Jorge3
DOI: 10.1590/S0004-27492003000400022
RESUMO
OBJETIVO: Relatar um caso de atrofia girata de coróide e retina com confirmação por meio da bioquímica do plasma. MÉTODO: Aferiu-se a melhor acuidade visual corrigida de ambos olhos (AO) em tabela de Snellen. Foram realizados biomicroscopia do segmento anterior, refração, mapeamento de retina, angiografia fluoresceínica, campo visual e dosagem da ornitina sérica (aminoacidograma). RESULTADOS: Paciente de 22 anos, sexo feminino, cor branca, apresentando alta miopia e acuidade visual (AV) 20/100 em AO. À biomicroscopia do segmento anterior apresentava catarata subcapsular posterior em AO. À oftalmoscopia foram verificadas lesões atróficas da coróide e da retina bem delimitadas em meia periferia de AO. O aminoacidograma constatou elevação correspondente ao complexo da ornitina. CONCLUSÃO: Relata-se um caso típico de atrofia girata, distrofia retiniana rara associada a hiperornitinemia.
Descritores: Atrofia girata; Coróide; Retina; Coroideremia
ABSTRACT
PURPOSE: To report a case of gyrate atrophy confirmed by biochemical blood analysis. METHODS: Best corrected visual acuity was evaluated. Biomicroscopy of the anterior segment, indirect ophthalmoscopy, fluorescein angiography and computerized visual fields were performed. Color vision was assessed and plasma ornithine level was determined. RESULTS: 22-year-old white female with high myopia, visual acuity of 20/100 in both eyes. Biomicroscopy showed posterior subcapsular cataract in both eyes. Retinography showed well-delineated atrophic lesions of the choroid and retina in the mid-periphery and around the optic nerve in both eyes. Blood aminoacid determination showed high levels of ornithine. CONCLUSION: We describe here a typical case of girate atrophy of the retina and choroid, a rare disease associated with high levels of plasma ornithine.
Keywords: Gyrate atrophy; Choroid; Retina; Choroideremia
INTRODUÇÃO
A atrofia girata da coróide e retina é uma desordem genética de herança autossômica recessiva considerada bastante rara, com cerca de 100 casos descritos na literatura mundial, sendo considerada menos comum que a coroideremia(1-2). Em um centro de referência dos Estados Unidos a atrofia girata representa 1,4% dos pacientes com distrofias coriorretinianas generalizadas. No New York University Medical Center, desde 1958, foi visto exatamente um paciente. A incidência dessa doença é maior na Finlândia, onde foram descritos 29 pacientes(3). Foi descrita inicialmente por Jacobson em 1888, e em 1896 Fuchs deu nome a esta doença que permanece até hoje(3). Sua base bioquímica, ou seja, a deficiência da enzima ornitina aminotransferase (OAT), foi elucidada em 1973. Em 1988, Inana identificou uma mutação no gene da OAT no cromossomo 10(1-5), com herança autossômica recessiva, com grande quantidade de afetados sendo filhos de casamentos consangüíneos(2-3,6).
Este trabalho consiste na descrição de um caso desta patologia que possui lesões coriorretinianas típicas associadas à catarata subcapsular posterior e alta miopia, tendo o caso sido elucidado clínica e bioquimicamente e tendo sido instituído a terapêutica adequada.
DESCRIÇÃO DO CASO
Mulher branca de 22 anos de idade, do lar, procedente de Ribeirão Preto, São Paulo, foi atendida no Setor de Retina e Vítreo do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP), queixando-se de baixa acuidade visual em AO desde a infância. Também relatava alta miopia e por este motivo foi encaminhada para mapeamento de retina. Ao exame oftalmológico, apresentava acuidade visual (AV) de 20/100 em AO aferida em tabela de Snellen, tonometria de aplanação de 15 mmHg em AO. À biomicroscopia verificou-se catarata subcapsular posterior em AO. Refração: olho direito (OD) -17,00 DE -1,50 DC a 1800; olho esquerdo (OE) -17,50 DE - 0,75 DC a 1800. No exame de mapeamento de retina foram observadas áreas de importante atrofia de retina e coróide bem delimitadas em meia periferia, sendo possível a visibilização dos grandes vasos coroideos (estágio 3 da doença). A angiografia fluorescente demonstrou hiperfluorescência por transmissão nas áreas de atrofia, com discreto vazamento nas bordas das áreas atróficas. O campo visual revelou importante constrição, compatível com padrão quase tubular, tendo sido poupado apenas os 10 graus centrais (Figura 2).

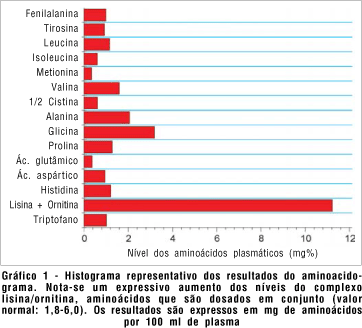
A paciente foi internada na enfermaria de nutrologia do HCFMRP-USP para realização de exames complementares, dentre eles o aminoacidograma, que revelou uma elevação correspondente ao complexo da ornitina (Gráfico 1), demonstrando indiretamente a deficiência na atividade da enzima ornitina aminotransferase. Após a realização dos exames e avaliação nutricional, foi orientada a mudança de hábitos alimentares (dieta hipoprotéica, com 35 g de proteína e pobre em arginina), além de suplementação de piridoxina (vitamina B6) 300 mg/dia. Seis meses após a instituição da terapêutica, o quadro oftalmológico manteve-se inalterado e foi programada cirurgia de facoemulsificação com implante de lente intra-ocular.
DISCUSSÃO
A atrofia girata da retina e coróide afeta geralmente indivíduos brancos. Existe descrito apenas 1 caso de uma família africana pertencente ao grupo racial negro(7). Afeta igualmente ambos os sexos, com início dos sintomas na infância com cegueira noturna e miopia axial, e é lentamente progressiva. A acuidade visual geralmente começa a diminuir da segunda a quinta décadas de vida, podendo atingir níveis de 20/200 ou menos em aproximadamente 10 anos. Esta queda é geralmente decorrente de formação de catarata, principalmente subcapsular posterior, como verificado em nossa paciente. Alterações atróficas ou edema na mácula também podem levar à baixa de visão(2,5-6,8). Cegueira legal geralmente ocorre por volta da quarta a sétima décadas de vida(5).
O defeito básico desta patologia está na deficiência da atividade da enzima OAT, dependente do fosfato de piridoxina (vitamina B6)(6), que está reduzida em cerca de 50%, acarretando aumento nos níveis de ornitina no plasma (6-10 vezes maiores que o normal), líquor, humor aquoso e urina. Tal aumento foi confirmado em nosso caso através do aminoacidograma, que revelou elevados níveis de ornitina no plasma. Este aminoácido está envolvido no ciclo da uréia, na síntese da poliaminas, creatininas e prolina, além do envolvimento no ciclo do ácido glutâmico. Este originará o glutarato, que por sua vez, dá origem ao alfa-cetoglutarato, composto que participa no ciclo do ácido cítrico que pela oxidação da glicose em dióxido de carbono é responsável por cerca de 80% da oxigenação retiniana(2,9-10). Ainda não está bem esclarecido se as alterações coriorretinianas são decorrentes da hiperornitinemia propriamente dita (pacientes com níveis elevados de ornitina, por diversas outras patologias, não desenvolvem as anomalias coriorretinianas) ou níveis reduzidos de prolina e glutamato(2). Porém a presença de elevação sérica da ornitina juntamente com as alterações retinianas descritas neste caso são achados patognomônicos(4). Noble, através de estudos histopatológicos, sugere que a atrofia da coriocapilar seja secundária a do EPR(6).
A disfunção dos fotorreceptores precede a evidência oftalmoscópica da doença(6). A oftalmoscopia indireta mostra múltiplas manchas em concha ou quase arredondadas de atrofia coriorretiniana na média periferia com bordos bem demarcados separando os tecidos normal e anormal, como verificado na nossa paciente. As alterações coriorretinianas podem ser associadas a degenerações do vítreo(6). A extrema periferia retiniana e a mácula são geralmente poupadas, a não ser em casos avançados. Em algumas áreas existe atrofia importante que permite a visibilização da esclera e grandes vasos da coróide, como aqui relatado(2). Nos estágios tardios os vasos retinianos sofrem extensa atenuação(5). Como na retinose pigmentar e coroideremia, a mácula parece ser a área mais resistente(6). Pacientes portadores têm fundoscopia normal, porém pode haver discreta elevação dos níveis de ornitina(10).
A angiografia fluoresceínica mostra hiperfluorescência nas áreas de lesões atróficas, com vazamento moderado nas margens da retina aparentemente saudável(2), como verificado em nosso caso, no qual também se verifica perda da coriocapilar e vasos coroidianos de tamanho médio nas áreas atróficas(4). Hipofluorescência devido a hiperpigmentação também pode ser notada(6).
O campo visual mostra constrição concêntrica de acordo com o grau de atrofia, com diminuição generalizada da sensibilidade, podendo haver escotomas na meia periferia(2,5). No presente caso, foi verificada grande constrição do campo visual de AO, compatível com a extensão das áreas de atrofia. A visão de cores tipicamente permanece intacta até as fases avançadas, assim como constatado no presente relato.
Alguns autores têm relatado achados sistêmicos como diminuição da função intelectual, alterações eletroencefálicas, anomalias nas fibras tipo 2 dos músculos esqueléticos, cabelos lisos e esparsos(2), alterações que não verificados no caso aqui descrito.
A atrofia girata da coróide e da retina pode levar a alterações nos exames de eletrofisiologia ocular: o eletrorretinograma apresenta nas fases iniciais da doença respostas elétricas normais, evoluindo para subvoltagem e eventualmente abolição total da resposta; o eletrooculograma também pode resultar em respostas elétricas subnormais(2).
O diagnóstico diferencial é feito principalmente com a coroideremia que causa atrofia difusa da coróide e do epitélio pigmentar por todo o fundo do olho, porém as lesões não são bem delimitadas e não seguem o padrão geográfico da atrofia girata, como verificado em nosso caso. Além disso, a coroideremia acomete o sexo masculino devido ao padrão de herança recessivo ligado ao X(1-2,10) e os pacientes não apresentam aumento nos níveis séricos de ornitina. Outra doença que pode ser considerada como diagnóstico diferencial é a degeneração "paving stone", mas a despeito da atrofia girata, a atrofia de coróide acontece na periferia, geralmente inferior(10).
O tratamento é controverso, basicamente consiste em evitar alimentos que aumentem a dosagem de ornitina: a)restrição de arginina (precursor da ornitina); b)administração de piridoxina (vitamina B6) estimula a atividade da OAT. Alguns autores acreditam que o tratamento precoce com esta droga retarda o desenvolvimento das lesões da retina e coróide(11). A dose não está bem estabelecida, pode-se tentar 20 mg/dia inicialmente, e aumentar para 500 mg/dia, se não houver resposta. Os pacientes responsivos à vitamina B6 geralmente têm um curso clínico menos severo e de progressão mais lenta do que os pacientes que não são responsivos. A interferência da manipulação dietética no estacionamento da progressão da
doença ainda não está bem estabelecida. Existem relatos bem documentados de progressão da atrofia apesar da queda nos níveis sangüíneos da ornitina por mais de dois anos. Também têm sido documentadas melhoras no ERG e acuidade visual em alguns casos(2). O seguimento deve ser feito com medidas freqüentes dos níveis de ornitina, inicialmente, para determinar a quantidade de vitamina B6 (piridoxina) que se deve suplementar e a quantidade de que proteínas devem ser restringidas de dieta. Níveis de ornitina entre 0.15 - 0.20 mM são aceitáveis. A freqüência dos testes sangüíneos pode ser reduzida após se estabilizarem os níveis de ornitina dentro desta faixa. Níveis séricos de amônia devem ser controlados em pacientes com restrição dietética de arginina(10). No presente caso foram adotadas as medidas dietéticas, que não surtiram efeito em termos de acuidade visual após 6 meses de seguimento.
REFERÊNCIAS
1. Abreu EB, Abreu M, Abreu RB, Garbim H. Atrofia girata de coróide e retina. Arq Inst Penido Burnier 1992;34:88-91.
2. Abujamra S. Retina e vítreo: clínica e cirurgia. São Paulo: Roca; 2000.
3. Carr RE. Hereditary choroidal disease. In: Ryan SJ. Retina. St Louis; Mosby: 1989. p. 447-56.
4. Moreira Jr. CA, Ávila M. Distrofias hereditárias da retina e coróide. Manual do CBO de retina e vítreo. Rio de Janeiro: Brasil Cultura Médica; 1999. p.173.
5. Kanski JJ. Degenerations and dystrophies of the fundus. In: Kanski JJ editor. Clinical Ophthalmology. 3rd ed. Londres, Inglaterra: Butterworth Heinemann; 2000. p. 420-21.
6. Noble KG. Choroidal distrophies. In: Guyer DR, Yannuzzi LA, Chang S, Shields JA, Green RW. Retina, vitreous, macula. Philadelphia: WB Saunders; 1999. p. 960-74.
7. Raitta C, Carlson S, Vannas–Sulonen K. Gyrate atrophy of the choroid and retina: ERG of the neural retina and the pigment epithelium. Br J Ophthalmol 1990;74:363-7.
8. Takki K. Gyrate atrophy of the choroid and retina associated with hyperornithinaemia. Br J Ophthalmol 1974;58:3-23.
9. Klauss V, Chana H. Gyrate atrophy of the choroid and retina with hiperornithinemia in an African family. Klin Monatsbl Augenheilkd 1983;183:497-9
10. Cullom Jr RD, Chang B. Retina: manual das doenças oculares "Wills Eyes Hospital". 2a ed. Rio de Janeiro: Cultura Médica; 1998. p. 355-7.
11. Baumann BW. Biochemical and therapeutical studies in a case of atrophia gyrate. Graefes Arch Clin Exp Ophthalmol 1982;218:21-4.
Endereço para correspondência
Dr. Rodrigo Jorge
Faculdade de Medicina de Ribeirão Preto - Depto. OFT/ORL/CCP
Avenida Bandeirantes, 3900
Ribeirão Preto (SP) - CEP 14048-900
E-mail: [email protected]
Recebido para publicação em 23.04.2002
Aceito para publicação em 27.11.2002