

Rafael Vidal Mérula1; Fernando Cançado Trindade2
DOI: 10.1590/S0004-27492006000300032
RESUMO
A degeneração marginal pelúcida da córnea caracteriza-se por afilamento estromal progressivo do segmento inferior da córnea, estendendo-se na posição de 4 horas às 8 horas, em forma de crescente. A área de adelgaçamento corneal mede entre 1 mm e 2 mm de largura e é separada do limbo corneoescleral por uma área de tecido corneal normal. Como no ceratocone, o tratamento inicial consiste na correção óptica com óculos ou lentes de contato rígidas. Entretanto, quando a doença apresenta-se em estágio avançado, inviabiliza-se a correção visual por meio de recursos ópticos, sendo necessária a utilização de procedimentos cirúrgicos, como a ressecção em cunha, ressecção lamelar em crescente, a ceratoplastia penetrante, a ceratoplastia lamelar, epiceratoplastia, e mais recentemente os implantes de anéis corneais intra-estromais.
Descritores: Doenças da córnea; Doenças da córnea; Topografia da córnea; Procedimentos cirúrgicos oftalmológicos
ABSTRACT
Pellucid marginal degeneration is characterized by a progressive stromal thinning of the inferior corneal segment, between 4 and 8 o'clock, with a crescentic shape. The area of corneal thinning has a width of about 1 to 2 mm, and it is separated from the corneoscleral limbus by an area of normal corneal tissue. The initial treatment consists of optical correction. However, when the disease progresses to advanced stages, surgical procedures are necessary such as wedge resection, lamellar crescentic resection, penetrating keratoplasty, lamellar keratoplasty, epikeratoplasty and, recently, intracorneal segments.
Keywords: Corneal diseases; Corneal diseases; Corneal topography; Ophthalmologic surgical procedures
INTRODUÇÃO
O termo "la dystrophie marginale infereure pellucide de la cornee" foi introduzido em 1957 por Schlaeppi(1). No entanto, a primeira caracterização detalhada da degeneração marginal pelúcida da córnea (DMPC) foi feita por Krachmer em um artigo publicado em 1978(2).
A DMPC é uma ectasia corneal pouco freqüente, não inflamatória, não ulcerativa, geralmente bilateral, sem predileção aparente por sexo, sem evidência de transmissão hereditária, acomete indivíduos entre 20 e 40 anos de idade(3-7).
A etiologia da DMPC não está estabelecida. A microscopia eletrônica de transmissão da córnea revela fibras colágenas anormalmente espaçadas com uma periodicidade de 100 nm a 110 nm, que contrasta com 60 nm a 64 nm achados em córneas normais(8). Tal condição também é encontrada em casos avançados de ceratocone. O enfraquecimento dessas fibras colágenas estromais na DMPC e em outras ectasias corneais resulta no afilamento corneal observado.
OBJETIVOS
Avaliar as características clínicas e topográficas que permitem o diagnóstico da DMPC, bem como revisar os tratamentos existentes para a correção desta ectasia corneal.
MÉTODOS
Realizou-se revisão da literatura, na qual pesquisaram-se artigos sobre DMPC publicados desde 1957 até o ano de 2004. Utilizou-se a Internet, através de seus sites de busca: MEDLINE, LILACS, BIREME, para aquisição dos artigos, além do acervo existente nas bibliotecas do Departamento de Oftalmologia e da Faculdade de Medicina da Universidade Federal de Minas Gerais.
Características clínicas
A DMPC caracteriza-se por um afilamento estromal do segmento inferior da córnea, estendendo-se de 4 horas às 8 horas, em forma de crescente, e apresenta desenvolvimento lento e progressivo (Figura 1). Verifica-se ausência de vascularização, depósitos de lipídios ou alterações de sensibilidade corneal(9). A área de adelgaçamento corneal mede entre 1 mm e 2 mm de largura e é separada do limbo corneoescleral por uma área de tecido corneal normal(4,7,10-11). Com a presença do afilamento corneal inferior ocorre uma protrusão, isenta de adelgaçamento (o que diferencia a DMPC do ceratocone), do tecido da córnea localizado acima desta área. Com este mecanismo fisiopatológico, os portadores de DMPC apresentam baixa acuidade visual em conseqüência a um astigmatismo irregular significativo, de difícil correção e que, em alguns casos, faz com que o uso de lentes de contato seja intolerável.

Existem estudos que relatam a associação entre DMPC e ceratocone(5,9-10,12), sendo que alguns autores consideram a DMPC uma variante do mesmo baseando-se em achados clínicos e histopatológicos(4,9).
A descompensação corneal com ruptura da membrana de Descemet e conseqüente entrada de fluido no estroma corneal também pode ocorrer na DMPC, e pode levar à hidropsia aguda seguida, geralmente, de vascularização e cicatrização(13).
Devemos considerar como diagnóstico diferencial as seguintes patologias: ceratocone, ceratoglobo, degeneração marginal da córnea (doença de Terrien)(4).
A DMPC pode ocorrer como uma ceratectasia iatrogênica após ceratomileusis assistida por excimer laser in situ (LASIK)(14). Trabalhos relatam a ocorrência de casos de DMPC com rápida progressão após LASIK para correção de miopia(14). É recomendável que haja um leito estromal residual da córnea de pelo menos 250 µm pós LASIK a fim de prevenir ceratectasias, e mesmo com este cuidado, complicações podem acontecer. Deve-se salientar que a DMPC é contra-indicação para cirurgia refrativa com qualquer leito estromal. Sabe-se que os dois principais parâmetros utilizados para avaliação pré-operatória de pacientes candidatos à cirurgia refrativa são refração estável e espessura corneal central adequada, entretanto, pacientes com alterações iniciais de DMPC podem apresentar tais parâmetros dentro da normalidade. Desse modo, é muito importante a avaliação cuidadosa da topografia de córnea em pacientes que irão submeter-se à cirurgia refrativa com o objetivo de detectar casos incipientes de DMPC.
Características topográficas
Topograficamente a DMPC apresenta-se com um aplanamento ao longo do eixo vertical central da córnea e um aumento da curvatura na periferia corneal inferior, que se estende para os meridianos corneais oblíquos inferiores da média periferia, desse modo, verifica-se um astigmatismo, irregular, contra a regra(3,15). Em geral, a mira ceratoscópica central demonstra forma de pêra. Nos mapas gráficos observamos o menor poder corneal ao longo de um estreito corredor central e paracentral. Na borda inferior deste corredor, o poder corneal aumenta em séries de bandas concêntricas com a aproximação do limbo. O maior poder corneal é notado ao longo da periferia inferior e dos meridianos corneais oblíquos inferiores da média periferia. O poder da periferia e média periferia da córnea diminuem lentamente em direção superior a partir dos meridianos corneais inferiores oblíquos (Figura 2). Este padrão descrito acima é distintamente diferente que o padrão observado no ceratocone, no qual uma pequena área de elevado poder corneal central é rodeada por bandas concêntricas de poderes progressivamente menores(3). Já na degeneração marginal de Terrien, pode-se verificar alterações topográficas similares às da DMPC, entretanto, não se observa aumento da curvatura da periferia corneal inferior que se estende a meridianos oblíquos inferiores da média periferia(15). Recentes trabalhos demonstram que wavefront pode ser utilizado na análise de aberrações corneais (ceratocone, DMPC, entre outras) como um estudo adjuvante à topografia de córnea acarretando em um aumento na identificação das aberrações de alta ordem(16).

Tratamento
Como no ceratocone, o tratamento inicial consiste na correção óptica com óculos ou lentes de contato rígidas. Entretanto, quando a patologia apresenta-se em estágio avançado, inviabiliza-se a correção visual por meio de recursos ópticos, sendo necessária a utilização de procedimentos cirúrgicos, como a ressecção em cunha, a ceratoplastia penetrante (CP), a ceratoplastia lamelar, epiceratoplastia e implante de anéis corneais intra-estromais.
Não cirúrgico
A correção dos astigmatismos irregulares causados pelas ectasias corneais primárias, como a DMPC, mantém-se como um desafio para os oftalmologistas. Com a progressão das alterações topográficas, a correção com óculos torna-se impossível. Dessa forma, resta-nos somente as lentes de contato como meio de correção óptica antes de se indicar cirurgia corretiva(17). Alguns trabalhos demonstram que o manejo não cirúrgico ainda é o mais utilizado na maioria dos casos desta degeneração corneal periférica(18). O tipo de lentes de contato a ser utilizado varia dependendo do estágio da DMPC. Para correção em estágios iniciais da doença, lentes tóricas gelatinosas são adequadas; em casos moderados, lentes de contato mais complexas de polimetilmetacrilato (PMMA) como lentes esclerais e lentes tóricas de PMMA, lentes rígidas gás permeáveis (RGP), lentes RGP tórica e lentes esclerais RGP também podem ser úteis. Lentes híbridas, que apresentam porção central rígida e porção periférica gelatinosa hidrofílica (exemplo: SoftPerm - CIBA Vision, Atlanta, GA), podem ser utilizadas(17).
Apesar de ser viável a realização de ceratoplastia penetrante em casos avançados, o enxerto corneal deve ser grande e excêntrico. Quando os enxertos são colocados muito próximos aos vasos límbicos, há um risco aumentado de vascularização pós-operatória e rejeição do enxerto. Adicionalmente, uma alta incidência de astigmatismo pós-operatório pode ocorrer devido à posição excêntrica do enxerto, o que torna difícil a adaptação de lentes de contato(18). Por isso, mesmo em casos moderados a avançados, deve-se dar preferência à adaptação de lentes de contato(17).
Existem estudos que relatam que a combinação de lentes, como as lentes híbridas (que apresentam porção central rígida e porção periférica gelatinosa hidrofílica), pode nos fornecer uma solução alternativa para pacientes com DMPC, possivelmente devido a uma excelente centração da porção RGP, obtendo uma boa acuidade visual (AV) e pelo conforto e estabilização da lente fornecida pela porção hidrofílica. Tais lentes apresentam o diâmetro da região central RGP entre 6,5 mm (Saturn II®) e 8,0 mm (SoftPerm®), com uma zona óptica de 7,0 mm (SoftPerm®) e a porção periférica gelatinosa hidrofílica com 20% de hidratação provendo um diâmetro da lente entre 13,0 mm (Saturn II®) e 14,3 mm (SoftPerm®). Nelas, a porção gelatinosa ultrapassa o limbo inferior prevenindo a descentração da lente durante os movimentos oculares(19).
Outros estudos demonstram bons resultados visuais com a adaptação de lentes RGP de grande diâmetro, sendo que quanto mais avançado o estágio da DMPC, maior o diâmetro da lente utilizado e menor acuidade visual atingida(17, 20).
Cirúrgico
A DMPC pode causar uma deterioração severa da visão. Lentes de contato rígidas, que são benéficas em casos leves da doença, falham nos casos graves. A cirurgia, geralmente, é o tratamento de última escolha, e um grande número de procedimentos cirúrgicos já foram tentados. Entre eles, podemos citar: ressecção em crescente, ressecção lamelar em crescente, ceratoplastia lamelar em crescente, ceratoplastia lamelar central, ceratoplastia penetrante e epiceratoplastia. O fato de haver procedimentos tão distintos, sendo que muitos deles ainda são utilizados atualmente, implica na inexistência de um consenso sobre um procedimento cirúrgico padrão(11).
Como a porção afilada da córnea está localizada de 1 mm a 2 mm do limbo corneoescleral inferior, a ceratoplastia penetrante deve ser descentrada inferiormente com a finalidade de englobar a área corneal mais fina, ou então, realizar o enxerto de grande diâmetro no qual virtualmente toda a córnea é substituída. Mesmo quando deslocados inferiormente, esses enxertos são de maior diâmetro que o usual objetivando a realização de suturas superiormente, evitando o eixo visual. A proximidade dos vasos límbicos aumenta o risco de vascularização e subseqüente rejeição do transplante. Adicionalmente, astigmatismos elevados no pós-operatório podem ocorrer em conseqüência de um enxerto excêntrico(6).
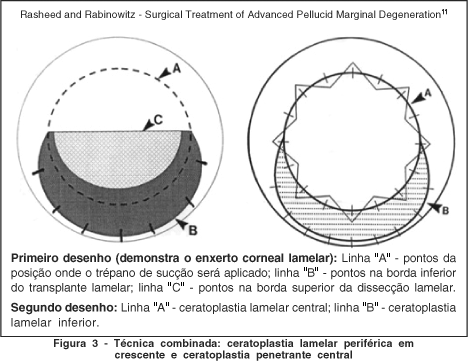
Além da ceratoplastia penetrante, outras modalidades de ceratoplastia também foram descritas para correção da DMPC. Shanzlin et al., relataram, em 1983, um caso de DMPC tratado com ceratoplastia lamelar em crescente(21) (tal caso teve o diagnóstico de DMPC questionado por Schnitzer, em 1984(22)). Em 1993, Kremer et al., descreveram a realização de procedimento cirúrgico em dois estágios, em um caso de DMPC moderada: primeiro, a ceratoplastia lamelar em crescente que geralmente está associada com uma baixa incidência de rejeição do enxerto e irá levar a uma espessura corneal relativamente normal, facilitando a cirurgia com um enxerto corneal central de espessura total, possibilitando a obtenção de uma espessura suave e regular, e uma topografia normal, e no segundo estágio, uma ceratoplastia penetrante central, obtendo bom resultado visual (AV de 20/30)(23); e em 2000, Rasheed, Rabinowitz publicaram a realização simultânea de ceratoplastia lamelar periférica em crescente e ceratoplastia penetrante central em 5 pacientes (5 olhos) portadores de DMPC, com bons resultados (Figura 3)(11).
A ressecção em crescente foi descrita por Barraquer em 1965 para o tratamento de astigmatismo congênito(24). Posteriormente, Troutman et al., descreveu a ressecção em cunha (um método similar à ressecção em crescente) para a correção de astigmatismos elevados pós-cirúrgicos(25). Em 1984, Caldwell et al, relataram o uso de procedimento similar ao de Troutman para tratamento de degeneração marginal de Terrien(26). Em 1989, Dubroff descreveu o primeiro relato de ressecção em cunha para correção de deficiência visual por DMPC. O grande problema dos procedimentos relatados acima é como calcular a quantidade ideal de ressecção para correção ceratométrica adequada(27). Segundo Duran et al., (1991), a melhor maneira é induzir uma correção excessiva nos primeiros dias de pós-operatório que desaparecerá após alguns meses(24) (Figuras 4 a 7). Em 1997, MacLean et al., publicaram um estudo retrospectivo no qual dez olhos de nove pacientes portadores de alterações típicas de DMPC foram submetidos à excisão corneal em cunha da área afilada inferiormente, sendo que no pré-operatório, a melhor acuidade visual corrigida variou de 20/40 a 20/200 com um astigmatismo ceratométrico médio associado de +13,8 D, e no pós-operatório, uma acuidade visual corrigida e estável de 20/30, ou melhor, foi alcançada em todos os casos em um tempo médio de 5,4 meses (variando de 3 a 12 meses), e o astigmatismo ceratométrico médio foi de 1,4 dioptrias (variando de 0,5 a 4 dioptrias); entretanto, em três pacientes houve desenvolvimento de pannus inferior leve relacionado à localização periférica das suturas, e um caso desenvolveu aparente hidropsia na ferida corneal após 9 anos de seguimento(5).




Alguns autores destacam as vantagens da ressecção em crescente: não é necessário tecido doador, evitando-se, assim, problemas de rejeição; não há risco de lesão de tecidos intra-oculares; a técnica é simples e reprodutível; e não impede a realização posterior de ceratoplastia em caso de recorrência da doença; e ressaltam as desvantagens do tratamento padrão para DMPC, a ceratoplastia: enxertos excêntricos e de grandes diâmetros que podem levar a elevados astigmatismos pós-operatórios, chances de sinéquias periféricas, e risco aumentado de rejeição em decorrência de vascularização limbar imediata(24).
Em março de 2000, Rodriguez-Gonzales-Herrero et al., descreveram um caso no qual o paciente era portador de DMPC e catarata, e foi realizada a cirurgia combinada de catarata (facoemulsificação), através de um acesso inferior, seguida de ceratectomia em cunha(28).
Além da ressecção em crescente, existem relatos da realização de ressecção lamelar em crescente (Cameron, 1992) na qual há preservação de camadas estromais corneais mais profundas, além da vantagem de não penetrar na câmara anterior, por conseguinte, algumas complicações podem ser evitadas: descolamento de retina, descolamento de coróide e endoftalmite(29) (Figura 8). No entanto, a técnica cirúrgica da ressecção lamelar em crescente é mais trabalhosa, e, segundo Cameron, se ocorrer a penetração na câmara anterior deve-se converter o procedimento para excisão de uma cunha de espessura total. A ressecção lamelar em crescente apresenta vantagens em relação a ceratoplastia penetrante: é um tratamento localizado e direcionado à área anormal da córnea, a incisão é menor e a câmara anterior só é penetrada por uma pequena paracentese (possibilita a aproximação das bordas corneais com estroma de espessura normal) e não utiliza tecido doador evitando problemas de rejeição ou transmissão de doença. Uma possível desvantagem da ressecção lamelar em crescente é que a acuidade visual geralmente é ruim pelos primeiros 6 meses após a cirurgia por causa da correção exagerada do astigmatismo e do astigmatismo irregular induzido pela sutura(5,29).

Outra técnica cirúrgica que também já foi empregada em casos avançados de DMPC é a epiceratoplastia. A epiceratoplastia foi inicialmente desenvolvida para corrigir afacia do adulto (epiceratofacia) e, a seguir, adaptada para tratamento de ceratocone. Posteriormente, após o trabalho de Fronterre, Portesani (1991), no qual foram relatados dois casos bilaterais e avançados de DMPC que foram tratados cirurgicamente com epiceratoplastia com melhora da topografia corneal, tal procedimento teve seu uso ampliado para outras degenerações ectásicas da córnea(10).
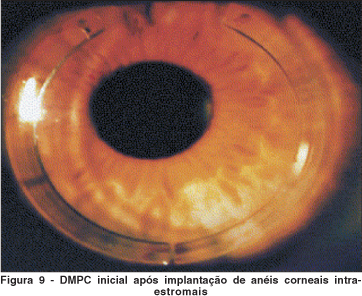
Recentemente, estudos têm sido publicados sobre o uso dos anéis intra-estromais corneais na DMPC(8,30) (Figura 9). Os anéis intra-estromais corneais foram primeiramente utilizados para correção de baixa miopia por Flemming et al.(8,30). O objetivo do uso de anéis intra-estromais corneais na DMPC é remodelar a córnea (sem realizar retirada de tecido), pela elevação da ectasia inferior, com aplanamento do tecido corneal ectásico, e diminuição do astigmatismo assimétrico. O primeiro relato do uso dos anéis intra-estromais em DMPC foi feito por Rodriguez-Prats et al., em julho de 2003(8). No trabalho acima, o paciente tinha 36 anos e apresentava, no pré-operatório, AV sem correção de 0,05 e com óculos (-2,0 -7,0 x 90) de 0,1; após um mês de cirurgia a acuidade visual sem correção era de 0,2, e com óculos (-8,0 -7,0 x 50) era de 0,3. Uma lente de contato híbrida (SoftPerm®, Ciba Vision) com a zona central gelatinosa permeável, zona periférica hidrofílica rígida, curva base de 8,00 mm, um diâmetro de 14,3 mm, e um poder de -9,0 dioptrias foi adaptada e a acuidade visual melhorou para 0,9. Em janeiro de 2004, Kymionis et al., relataram mais um caso de utilização de anéis intra-estromais corneais(30) (Figura 10). O paciente de 42 anos apresentava refração manifesta de +3,75 -8,50 x 85 no OD e +2,00 -4,50 x 90 no OE, refração cicloplégica de +4,25 -8,50 x 85 no OD e +2,50 -4,25 x 90 no OE, AV sem correção de conta dedos em AO, e com óculos era de 20/50 no OD e 20/32 no OE. O paciente era intolerante ao uso de lentes de contato. O procedimento cirúrgico foi realizado no olho direito com a inserção de dois segmentos de anel intra-estromal. Onze meses após o procedimento, a AV sem correção no OD era de 20/200, com óculos era de 20/25 (refração manifesta de +4,50 -5,50 x 85, refração cicloplégica +5,00 - 5,50 x 85), apresentado melhora do padrão topográfico. Segundo Kymionis et al., em casos de DMPC avançados devem-se utilizar anéis com menor espessura (0,25 mm), caso planejam-se inseri-los na parte inferior da córnea para evitar perfuração(30). Além disso, acrescenta que maior seguimento de pacientes submetidos a esta técnica é necessário para observar a possibilidade de estabilização ou eliminação da progressão da doença ectásica; e ainda, a implantação em diferentes regiões da córnea deve ser examinada para identificar o melhor lugar. Entretanto, os anéis intra-estromais corneais parecem oferecer uma alternativa minimamente invasiva para pacientes com DMPC inicial.

A DMPC está inserida no grupo das doenças ectásicas da córnea e é caracterizada por um afilamento estromal do segmento inferior da córnea, estendendo-se de 4 horas às 8 horas, com 1 mm a 2 mm de largura e é separada do limbo corneoescleral por uma área de tecido corneal normal em forma de crescente. Com a presença do afilamento corneal inferior ocorre uma protrusão, isenta de adelgaçamento (o que diferencia a DMPC do ceratocone), do tecido da córnea localizado acima desta área.
A correção dos astigmatismos irregulares causados pelas ectasias corneais primárias, como a DMPC, ainda é de difícil execução. A primeira opção é a correção com óculos, entretanto, com a progressão das alterações topográficas, lentes de contato RGP de grande diâmetro e lentes híbridas devem ser tentadas antes de se indicar cirurgia corretiva. A cirurgia, geralmente, é o tratamento de última escolha, sendo utilizada em casos moderados e avançados da doença. Um grande número de procedimentos cirúrgicos já foi tentado: ressecção em crescente, ressecção lamelar em crescente, ceratoplastia lamelar em crescente, ceratoplastia lamelar central, ceratoplastia penetrante e epiceratoplastia. O fato de haver procedimentos tão distintos, sendo que muitos deles ainda são utilizados atualmente, implica na inexistência de um consenso sobre um procedimento cirúrgico padrão. Recentemente, os segmentos intra-estromais corneais de PMMA passaram a fazer parte do arsenal terapêutico disponível para o tratamento cirúrgico da DMPC.
REFERÊNCIAS
1. Schlaeppi V. La dystrhophie marginale inférieure pellucide de la cornée. Bibl Ophthalmol. 1957;12(47):672-7.
2. Krachmer JH. Pellucid marginal corneal degeneration. Arch Ophthalmol. 1978;96(7):1217-21.
3. Maguire LJ, Klyce SD, McDonald MB, Kaufman HE. Corneal topography of pellucid marginal degeneration. Ophthalmology. 1987;94(5):519-24.
4. Bethem MM, Abreu GB, Simão AN. Degeneração marginal pelúcida da córnea. [texto na Internet]. [citado em 2003 Ago 2]. Disponível em: http://www.drgustavoabreu.com.br/trabalhos_degeneracaopeludica.htm
5. MacLean H, Robinson LP, Wechsler AW. Long-term results of corneal wedge excision for pellucid marginal corneal degeneration. Eye. 1997;11(Pt5):613-7. Comment in: Eye. 1997;11(Pt 5):579-80.
6. Varley GA, Macsai MS, Krachmer JH. The results of penetrating keratoplasty for pellucid marginal corneal degeneration. Am J Ophthalmol. 1990;110(2):149-52.
7. Biwas S, Brahma A, Tromans C, Ridgway A. Management of pellucid marginal corneal degeneration. Eye. 2000;14(Pt 4):629-34.
8. Rodriguez-Prats J, Galal A, Garcia-Lled M, De La Hoz F, Alió JL. Intracorneal rings for the correction of pellucid marginal degeneration. J Cataract Refract Surg. 2003;29(7):1421-4.
9. Kayazawa F, Nishimura K, Kodama Y, Tsuji T, Itoi M. Keratoconus with pellucid marginal corneal degeneration. Arch Ophthalmol. 1984;102(6):895-6.
10. Fronterre A, Portesani GP. Epikeratoplasty for pellucid marginal corneal degeneration. Cornea. 1991;10(5):450-3.
11. Rasheed K, Rabinowitz YS. Surgical treatment of advanced pellucid marginal degeneration. Ophthalmology. 2000;107(10):1836-40.
12. Chesnutt DA, Cohen Kl. Pellucid marginal corneal degeneration 12 years after penetrating keratoplasty for keratoconus. Cornea. 1998;17(2):236-8.
13. Lang PJ, Seitz B, Volcker HE. [Long-term results after perforating corneo-scleroplasty in a case of acute unilateral superior pellucid marginal corneal degeneration]. Klin Monatsbl Augenheilkd. 2003;220(4):262-7. German.
14. Fogla R, Rao SK, Padmanabhan P. Keratectasia in 2 cases with pellucid marginal corneal degeneration after laser in situ keratomileusis. J Cataract Refract Surg. 2003;29(4):789-91.
15. Karabatsas CH, Cook SD. Topographic analysis in pellucid marginal corneal degeneration and keratoglobus. Eye. 1996;10(Pt 4):451-5.
16. Pepose J, Pepose J. Wavefront aberrations in patients with keratoconus and pellucid marginal degeneration [abstract]. Invest Ophthalmol Vis Sci. 2004; 45:E-Abstract, 2893.
17. Kompella VB, Aasuri MK, Rao GN. Management of pellucid marginal corneal degeneration with rigid gas permeable contact lens. CLAO J. 2002;20(4): 140-5.
18. Tzelikis PF, Komatsu FTO, Laibson PR, Cohen EJ, Rapuano CJ, Hammersmith KM. Management of pellucid marginal cornea degeneration [abstract]. Invest Ophthalmol Vis Sci 2004;45:E-Abstract,1528.
19. Astin CL. The long-term use of the SoftPerm lens on pellucid marginal corneal degeneration. CLAO J. 1994;20(4):258-60.
20. Raizada K, Sridhar MS. Nomogram for spherical RGP contact lens fitting in patients with pellucid marginal corneal degeneration (PMCD). Eye Contact Lens. 2003;29(3):168-72.
21. Schanzlin DJ, Sarno EM, Robin JB. Crescentic lamellar keratoplasty for pellucid marginal degeneration. Am J Ophthalmol. 1983;96(2):253-4.
22. Schnitzer JI. Crescentic lamellar keratoplasty for pellucid marginal degeneration. Am J Ophthalmol. 1984;97(2):250-2.
23. Kremer I, Sperber LT, Laibson PR. Pellucid marginal degeneration treated by lamellar and penetrating keratoplasty. Arch Ophthalmol. 1993;111(2):169-70.
24. Duran JA, Rodriguez-Ares MT, Torres D. Crescentic resection for the treatment of pellucid corneal martinal degeneration. Ophthalmic Surg. 1991;22(3): 153-6.
25. Troutman RC. Corneal wedge resections and relaxing incisions for postkeratoplasty astigmatism. Int. Ophthalmol Clin. 1983;23(4):161-8.
26. Caldwell DR, Insler MS, Boutros G, Hawk T. Primary surgical repair of severe peripheral marginal ectasia in Terrien´s marginal degeneration. Am J Ophthalmol. 1984;97:332-6.
27. Dubroff S. Pellucid marginal corneal degeneration: report on corrective surgery. J Cataract Refract Surg. 1989;15(1):89-93.
28. Rodriguez-Gonzales-Herrero ME, Ortega AR, Mora-Figueroa JM. Surgical treatment of pellucid marginal degeneration associated with cataract. J Cataract Refract Surg. 2000;26(3):309-11.
29. Cameron JA. Results of lamellar crescentic resection for pellucid marginal corneal degeneration. Am J Ophthalmol. 1992;113(3):293-302.
30. Kymionis GD, Aslanides IM, Siganos CS, Pallikaris IG. Intacs for early pellucid marginal degeneration. J Cataract Refract Surg. 2004;30(1):230-3.
31. Flemming JF, Wan WL, Schanzlin D. The theory of corneal curvature change with the intrastromal corneal ring. CLAO J. 1989;15(2):146-50.
Endereço para correspondência:
Rafael Vidal Mérula
Rua Oswaldo Cruz, 98
Juiz de Fora (MG) CEP 36015-430
E-mail: [email protected]
Recebido para publicação em 08.09.2004
Versão revisada recebida em 08.11.2005
Aprovação em 02.12.2005
Trabalho realizado no Serviço de Catarata, Córnea, Doenças Externas Oculares e Cirurgia Refrativa do Hospital São Geraldo - Hospital Das Clínicas - Universidade Federal de Minas Gerais.