

Sílvia Ligório Fialho1; Armando da Silva Cunha Júnior1
DOI: 10.1590/S0004-27492004000500028
RESUMO
O método mais comum de administração de drogas no olho é por meio de colírios. Entretanto, por este método, não é possível atingir a concentração terapêutica nos fluidos e tecidos posteriores do olho. A administração sistêmica apresenta reduzido acesso ao segmento posterior do olho devido à presença das barreiras oculares. Injeções subconjuntivais e retrobulbares não são capazes de proporcionar níveis adequados da droga, e a injeção intravítrea é método invasivo, inconveniente e que apre-senta riscos de perfuração do bulbo ocular ou descolamento da retina. A iontoforese, no entanto, apresenta-se como alternativa para o transporte de doses terapêuticas de drogas para o segmento posterior do olho. A iontoforese é uma técnica que consiste na administração de drogas para o organismo através dos tecidos, utilizando um campo elétrico. O eletrodo ativo, que se encontra em contato com a droga, é colocado no local a ser tratado, e um segundo eletrodo, com a finalidade de fechar o circuito elétrico, é colocado em outro local do organismo. O campo elétrico facilita o transporte da droga, que deve se encontrar, preferencialmente, na forma ionizada. A iontoforese pode ser considerada como um método seguro e não invasivo de transporte de drogas para locais específicos do olho. Aplicada experimentalmente para o tratamento de doenças oculares, esta técnica tem evoluído muito nos últimos anos e, atualmente, testes clínicos de fase III encontram-se em andamento.
Descritores: Iontoforese; Oftalmopatias; Sistemas de liberação de medicamentos; Olho; Tecnologia farmacêutica
ABSTRACT
The most traditional method of ocular drug delivery is through the use of eyedrops. However, by this method, the therapeutic concentration in deep ocular fluids and tissues can not be efficiently reached. Systemic administration presents poor access to the posterior segment of the eye due to ocular barriers. Subconjuntival and retrobulbar injections are not able to produce adequate levels of the drug, and intravitreal injection is an invasive and problematic procedure that may involve the risk of ocular perforation or retinal detachment. Thus, iontophoresis presents an alternative technique for the delivery of therapeutic drug doses to the posterior segment of the eye. Iontophoresis is a technique that consists of the administration of drugs to the body through tissues using an electric field involving a small potential difference. The active electrode, which is in contact with the drug, is placed at the site to be treated, and a second electrode, with the purpose to close the electric circuit, is placed at another site of the body. The electric field facilitates the transport of the drug that should be mainly ionized. Iontophoresis is considered to be a safe and noninvasive technique of drug delivery to specific sites of the eye. This technique, experimentally applied to the treatment of ocular diseases, has advanced in the last years and, at present, phase III clinical trials are in progress.
Keywords: Iontophoresis; Eye diseases; Drug delivery systems; Eye; Technology; pharmaceutical
INTRODUÇÃO
Em tratamentos de doenças oftálmicas, é necessário o transporte de drogas para o bulbo ocular, embora as condições para este transporte variem dependendo do objetivo médico em particular. Por exemplo, os níveis de concentração de uma droga podem ser requeridos no humor vítreo para tratar uma doença específica do segmento posterior do olho. Entretanto, para outras condições patológicas, pode ser eficiente o transporte e a distribuição de uma droga sobre toda a superfície da esclera ou para tecidos intra-esclerais. Portanto, dependendo da doença a ser tratada, pode ser necessária a aplicação de uma droga destinada a uma ampla área ocular ou a concentração em uma pequena região do olho(1).
Um método tradicional de administração de drogas na superfície ocular é por meio de colírios. Utilizando este método, vários tipos de drogas podem ser transportados para o olho, tais como antibióticos, corticosteróides, antihistamínicos, entre outros. A utilização de colírios, entretanto, é eficiente para o tratamento de doenças do segmento anterior do olho, mas pode causar toxicidade na córnea devido à presença de conservantes nas formulações e, geralmente, são necessárias administrações repetidas freqüentes. O tratamento com colírios não é efetivo em doenças do segmento posterior do olho, pois a droga é rapidamente eliminada pelas lágrimas, além de não ser capaz de atingir concentrações terapêuticas adequadas no vítreo, na retina e na coróide. A administração sistêmica, muitas vezes utilizada, apresenta reduzido acesso ao segmento posterior do olho devido à presença das barreiras hemato-aquosa e hematorretiniana e pode promover importantes efeitos adversos ao paciente. Injeções subconjuntivais e retrobulbares também não são capazes de proporcionar níveis adequados da droga, enquanto a injeção intravítrea é um método invasivo, inconveniente e algumas vezes apresenta riscos de perfuração do bulbo ocular ou descolamento da retina. Atualmente, a iontoforese é uma técnica que tem sido proposta como alternativa para o transporte de doses terapêuticas de drogas para o segmento posterior do olho(1).
A iontoforese, termo grego que significa transferência iônica, é um procedimento em que íons são conduzidos através de uma barreira por uma corrente elétrica de baixa intensidade, a qual modifica a permeabilidade das células e facilita a penetração de drogas ionizadas através das membranas biológicas(2). A energia elétrica utilizada, por aumentar o grau de penetração dos íons, proporciona uma maior concentração da droga no local de ação desejado(3). O principal mecanismo pelo qual a iontoforese aumenta a penetração de substâncias ionizadas pode ser simplificado como: "cargas semelhantes se repelem e cargas opostas se atraem".
A iontoforese é definida como um processo de transferência de drogas ionizadas através de uma membrana, como a córnea, para um tecido pelo uso de uma diferença de potencial elétrico entre dois eletrodos(4). O transporte por iontoforese depende de uma força eletromotiva que repele íons de um eletrodo de mesma carga e os faz migrar para um eletrodo de carga oposta.
O processo da iontoforese para terapia local deve, geralmente, obedecer alguns requisitos, tais como: a droga deve ser utilizada no seu estado ionizado e aplicada no eletrodo de mesma carga; e a condição ou doença em tratamento precisa ser em uma superfície do organismo ou próximo a ela. Como vantagem, efeitos adversos sistêmicos são eliminados durante curtos tratamentos já que a quantidade de droga que atinge a corrente sangüínea é reduzida(4).
Os principais benefícios da iontoforese são: a redução dos riscos e inconvenientes da infusão intravenosa contínua; a prevenção de alterações inter e intrapaciente na absorção e metabolismo, muitas vezes observada após administração oral do medicamento; o aumento da eficácia terapêutica pela eliminação do metabolismo de primeira passagem pelo fígado; a redução da possibilidade de superdosagem ou subdosagem, pelo transporte contínuo da droga, programado dentro da faixa terapêutica desejada; a possibilidade de utilização de uma droga com curta meia-vida biológica; o fornecimento de um regime terapêutico simplificado, levando a melhor aceitação do paciente ao tratamento; a possibilidade de término imediato da medicação, caso necessário, por uma simples interrupção da entrada de droga pelo sistema de iontoforese; o rápido início de liberação da droga no tecido; e o ajuste do perfil da corrente para atingir a cinética de liberação desejada da droga(2). Outras vantagens incluem a possibilidade de uma difusão adequada da droga no olho devido à obtenção de concentrações maiores e mais prolongadas na retina e no vítreo; a segurança do sistema de iontoforese para os pacientes, já que os aplicadores utilizados são estéreis e não se observam alterações significativas nem sinais de infecção ou ulceração no local; a ausência de dor durante a aplicação, sendo necessária apenas à administração tópica de anestésico para evitar o desconforto do contato do aplicador com o olho; a rapidez da aplicação, não sendo necessárias salas especiais ou preparação prévia do paciente; a economia do tratamento, por não requerer hospitalização e não utilizar elevadas quantidades de droga; e, segundo estudos em andamento, por possibilitar o tratamento de várias doenças, tais como inflamações, infecções bacterianas e fúngicas, hipervascularização, entre outras(1).
As maiores desvantagens do transporte de drogas por iontoforese são os riscos de queimaduras e choques resultantes da utilização de correntes elétricas elevadas e por longos períodos. Os riscos de queimadura podem ser causados por fatores como o contato dos eletrodos com o olho, superdosagem, presença de lesões no local de aplicação, alterações significativas de pH e elevada intensidade da corrente(2).
Os primeiros relatos da utilização da iontoforese datam de 1900, quando o pesquisador Leduc(5) relatou o potencial deste procedimento como sistema de transporte de drogas ao observar que coelhos sofreram ataques letais minutos após a introdução de estricnina por iontoforese transcutânea. Harris(6), em seguida, descreveu as primeiras aplicações da iontoforese na medicina, utilizando a técnica para o transporte das seguintes substâncias: sulfato de cobre para o tratamento de tinea pedis e cervicite crônica, sulfato de zinco para o tratamento de otite crônica e rinite vasomotora, nitrato de prata para o tratamento de osteoartrite e artrite reumatóide. A iontoforese também foi utilizada no transporte de pilocarpina transcutânea em pacientes com fibrose cística(7), de corticosteróides para o tratamento de condições músculo-esqueléticas e urológicas(8), de anes-tésicos locais na membrana timpânica e na mucosa periodontal(9-10), de fluoreto de sódio para redução da sensibilidade dental(11), de monofosfato de vidarabina para o tratamento de herpes simplex(12) e de gentamicina no controle de queimaduras auriculares(13).
Em oftalmologia, a iontoforese foi empregada pela primeira vez em 1908 quando o pesquisador alemão *Wirtz(1) utilizou uma corrente elétrica sobre a superfície do bulbo ocular, visando o tratamento de condições como úlceras de córnea, ceratite e episclerite. Jones, Maurice e Hughes, Maurice originalmente publicaram a idéia de utilização da iontoforese para o aumento do transporte de drogas nos tecidos oculares(14-15) e, a partir desta época, os métodos de aplicação da iontoforese foram revistos.
Em particular, observou-se que, quando se utiliza baixa intensidade de corrente elétrica, a técnica é segura e não induz alterações estruturais na córnea(16-17). Diferentes aplicações da iontoforese em oftalmologia clínica e experimental, principalmente no tratamento de infecções bacterianas e virais, inflamações, glaucoma, entre outras patologias que afetam milhões de pessoas a cada ano em todo o mundo, têm sido descrita(1,16-21).
A iontoforese é uma técnica de interesse particular no transporte de várias drogas, para diferentes tecidos do olho, incluindo o segmento posterior e, principalmente, para o espaço subretiniano para atingir a retina e a coróide(1). É uma técnica não-invasiva e sua aplicação pode ser repetida quantas vezes forem necessárias, sem o risco de efeitos adversos. Por meio dela é possível transportar moléculas clássicas, novas drogas, assim como oligonucleotídeos(18). A iontoforese permite novas modalidades terapêuticas para tratar doenças oculares degenerativas, já que ela contribui para o acúmulo preferencial de drogas na úvea e na retina, tecidos alvos para possível terapia gênica de doenças oculares humanas.
Técnica da iontoforese
O sistema de iontoforese, geralmente, é composto por um aplicador ocular estéril, normalmente descartável, o qual recebe a droga, e uma fonte de energia elétrica (gerador à base de bateria) conectada a um eletrodo de retorno(4). O aplicador deve conter tubos de conexão ao gerador, ao eletrodo de retorno e a uma seringa por onde a droga é injetada no aplicador (Figura 1).
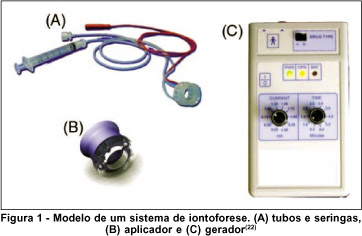
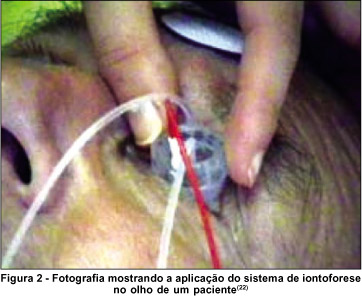
A formulação da droga contendo a molécula ionizada é colocada no aplicador, sendo este o compartimento do eletrodo de mesma carga, ou seja, uma droga carregada positivamente deve ser colocada no compartimento anodo(4). Outro eletrodo é colocado em outro local do organismo para completar o circuito elétrico (Figura 2). A droga, portanto, servirá como condutora de corrente através dos tecidos do olho.
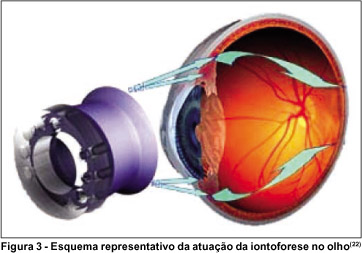
A iontoforese envolve a aplicação de uma corrente elétrica direta, a qual supera a resistência superficial do epitélio da córnea, conduzindo a droga através do epitélio corneal semipermeável, para tecidos oculares internos, tais como o estroma corneal e o humor aquoso(23) (Figura 3).
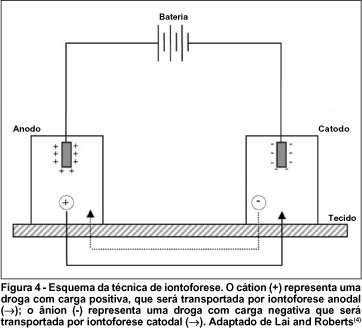
No momento em que a corrente é aplicada, o campo elétrico direciona o movimento dos íons presentes de forma que cargas positivas no compartimento anodo movem-se em direção ao catodo, enquanto os ânions movem-se na direção oposta(3).
A iontoforese anodal ocorre quando um eletrodo anodo (carga positiva) é colocado em uma solução contendo íons da droga carregados positivamente (cátions) e o catodo (carga negativa) é colocado em uma solução receptora em localização próxima(4). A iontoforese catodal é o contrário da anodal e envolve o movimento de um ânion (Figura 4).
Diversos fatores podem influenciar o mecanismo de transporte de drogas pela iontoforese, entre eles destacam-se a estrutura da droga, o comportamento dos íons do soluto em solução incluindo a condutividade, a resistência do transporte do íon através do tecido, a composição dos veículos utilizados e a influência de outros íons presentes no processo de transporte de droga(3). Estes fatores devem ser avaliados para o desenvolvimento de um sistema de iontoforese prático e eficiente.
A iontoforese apresenta o potencial de ultrapassar muitas barreiras físicas para a absorção tópica de drogas. Em geral, uma aplicação clínica bem sucedida precisa obedecer aos seguintes requerimentos: as moléculas das drogas devem ser relativamente pequenas e estar predominantemente ionizadas no pH fisiológico do olho(4).
O olho é um órgão ideal para o transporte de drogas por iontoforese, pois o humor aquoso e o humor vítreo são excelentes condutores elétricos(18). Além disso, sendo a córnea avascular, a passagem de íons ocorre sem que eles sejam eliminados pela circulação sangüínea.
O transporte de drogas utilizando a iontoforese ocorre através de regiões de baixa resistência elétrica. As rotas podem ser ou não as mesmas que aquelas utilizadas durante a difusão passiva de solutos, já que a aplicação de um potencial elétrico pode causar modificações na permeabilidade do tecido e criar novas vias de penetração(2).
Hughes e Maurice(15) detalharam fatores que controlam a penetração de drogas por meio da iontoforese, sendo a intensidade da corrente, i, e a duração da iontoforese, t, os principais parâmetros. Além disso, a penetração pode também ser proporcional à concentração da droga, Cd. A concentração de substâncias ionizadas adicionais, Ci, que competem com a droga no transporte da corrente, é um outro fator que controla a penetração da droga. A permeabilidade da droga no tecido, Pd, e a dos íons competidores, Pi, são variáveis que também influenciam a penetração. Observando estes parâmetros, foi proposta a equação representada a seguir para quantificar a quantidade de droga, md, que penetra no epitélio durante a iontoforese, sendo F a constante de Faraday (9,65 x 104 Cmol-1):
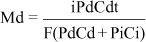
No caso de a concentração da droga ser muito mais elevada que a concentração dos íons competidores, a intensidade da corrente e a duração da iontoforese se tornam as únicas variáveis determinantes da penetração da droga.
A quantidade de droga transportada é diretamente proporcional à quantidade de carga passada, que depende da duração da corrente aplicada e da área da superfície ocular em contato com o compartimento ativo do eletrodo(2). Um estudo de permeabilidade cutânea, realizado por Sanderson et al, mostrou que o aumento da área de aplicação da iontoforese permitiria uma aplicação de maior corrente, de forma que um fluxo adequado poderia ser obtido para solutos com dificuldade de transporte(24). Entretanto, o valor máximo da corrente que pode ser utilizado é limitado por motivos de segurança ao paciente.
O tampão utilizado na solução doadora durante a iontoforese deve assegurar que a maioria das moléculas se encontre na forma ionizada e que nenhuma mudança significativa de pH ocorra durante a utilização do sistema(3). Os íons presentes no tampão, no entanto, competem com os íons da droga durante o transporte, principalmente quando o veículo contém íons sódio e/ou cloreto, os quais podem predominar sobre a penetração devido ao menor tamanho iônico e a melhor mobilidade quando comparados aos íons das drogas. Portanto, o tampão ideal é aquele que contém íons em uma determinada concentração que torna sua contribuição mínima para a corrente transportadora mas que apresenta capacidade tamponante suficiente para manter o pH próximo da estabilidade.
Entre as substâncias que apresentam íons de tamanhos semelhantes, o fluxo iontoforético varia de acordo com a natureza (ânion ou cátion) e o tamanho da carga desses íons(3).
A concentração da droga e seu impacto no fluxo iontoforético é um parâmetro bastante estudado e discutido(2). Um simples aumento na quantidade de droga na formulação, não necessariamente aumenta o número de moléculas transportadas na membrana; as propriedades físico-químicas da droga podem afetar a capacidade da molécula de interagir com as estruturas dos tecidos durante o transporte iontoforético. As formas de sais das drogas são preferíveis para o transporte por iontoforese devido à alta densidade de carga e solubilidade.
O desenvolvimento de um sistema de iontoforese envolve um fluxo elétrico direto, controlável, que completa um circuito elétrico no organismo(1). O tipo e a carga do eletrodo utilizado para a transferência de elétrons são fatores muito importantes. O eletrodo de platina tem se mostrado o melhor pois reduz a liberação de íons que o constituem e a toxicidade.
Aplicações e estudos
O transporte de drogas no olho por iontoforese tem sido bastante estudado, principalmente para o tratamento de doenças do segmento posterior.
Estudos preliminares em que o sulfato de gentamicina foi aplicado por iontoforese em olhos de macacos, mostraram que a técnica foi segura, efetiva e apresentou-se como um método não-invasivo de produção de elevada concentração de antibiótico no humor vítreo(25).
Em um modelo de ceratite bacteriana provocada por Pseudomonas, o método de iontoforese ocular de gentamicina, tobramicina ou ciprofloxacina mostrou-se superior ao tratamento com colírios na redução de Pseudomonas na córnea(23). Além disso, a técnica se mostrou segura e não tóxica para o epitélio corneal de coelhos.
O potencial da iontoforese no tratamento de doenças oculares experimentais foi estudado por Behar-Cohen et al(16). Este grupo de pesquisadores avaliou os benefícios da iontoforese ocular, em ratos, no tratamento de uveíte experimental induzida por endotoxina, utilizando dexametasona como droga. Os resultados mostraram que o tratamento da uveíte foi tão efetivo quanto à administração intraperitoneal da droga, sem a ocorrência de efeitos adversos.
Asahara et al avaliaram a transferência de um oligonucleotídeo (S-ODNs) para os tecidos oculares por iontoforese, a estabilidade da substância no olho e a possibilidade de danos aos tecidos oculares de coelhos(26). Os pesquisadores observaram que o S-ODNs foi detectado na câmara anterior, no vítreo e na retina após 5, 10 e 20 minutos, respectivamente, de início da iontoforese. Neste estudo, não foi observado nenhum sinal de inflamação ou degeneração nos tecidos oculares provocado pela técnica. Os resultados mostraram que a iontoforese é um método efetivo de transporte de genes para olhos de coelhos.
A avaliação da penetração intra-ocular de succinato de metilprednisolona também foi estudada pelo grupo de Behar-Cohen et al(27). Neste trabalho, o perfil farmacocinético da droga foi comparado após sua administração em olhos de coelhos por meio de iontoforese ou injeção intravenosa. Os resultados obtidos mostraram que no grupo de animais ao qual a técnica de iontoforese foi aplicada, as concentrações da droga foram maiores com o aumento da intensidade e da duração da corrente. Quando comparados aos da administração intravenosa, utilizando a iontoforese, foram obtidos níveis mais elevados e sustentados de metilprednisolona na retina e na coróide dos olhos de coelhos e também uma absorção sistêmica insignificante. Além disso, a técnica não promoveu toxicidade clínica ou lesões histológicas.
Voigt e colaboradores avaliaram o potencial da iontoforese no aumento da penetração ocular de oligodesoxi-ribonucleotídeos (ODNs) em ratos(28). Foi observado que a iontoforese facilitou a penetração do ODN intacto nos tecidos intra-oculares de ratos e concluiu-se que o transporte desta substância pode ser significativamente aumentado utilizando esta técnica, demonstrando seu potencial na terapia gênica de doenças oculares humanas.
Em um estudo realizado por Vollmer et al, a concentração e a distribuição da amicacina, transportada para olhos de coelhos por meio de iontoforese, foram avaliadas(29). Os resultados mostraram que concentrações de amicacina no humor vítreo, segmento anterior, esclera, retina e coróide encontravam-se acima da concentração inibitória mínima e que a droga foi transportada para os tecidos oculares de maneira reprodutível e controlável.
Em um trabalho desenvolvido por Monti et al, foi avaliado, in vitro, o efeito da iontoforese na penetração de maleato de timolol e cloreto de betaxolol em córneas de coelhos(20). A penetração corneal do timolol, uma substância mais hidrossolúvel, foi superior à do betaxolol, substância mais lipossolúvel, quando se utilizou a iontoforese. Observou-se que, para ambas drogas, a penetração transcorneal por meio da iontoforese foi influenciada apenas pela intensidade da corrente e pelo tempo de duração do tratamento. O aumento da penetração corneal observado não foi acompanhado por sinais de lesão no epitélio corneal.
Em um modelo de neovascularização, o potencial da iontoforese no transporte de oligonucleotídeos (ODN) para olhos de ratos foi avaliado(30). Os ODNs aplicados topicamente, sem a utilização de corrente elétrica, não penetraram na córnea e se mantiveram na camada superficial do epitélio. ODNs transportados por iontoforese penetraram em todas as camadas da córnea e também foram detectados na íris. Nas córneas que receberam indução de neovascularização, os ODNs foram localizados dentro das células endoteliais vasculares do estroma. A corrente aplicada durante a iontoforese não promoveu nenhum sinal detectável de lesão ocular.
A tolerância ocular da iontoforese foi estudada em voluntários sadios(31). Foram utilizados aplicadores de hidrogel contendo solução salina balanceada. Os voluntários foram avaliados antes e após 22 horas da aplicação da técnica. Os aplicadores foram bem tolerados e nenhuma alteração clínica significativa foi observada nos olhos dos pacientes.
A eficácia da penetração de gentamicina na córnea de coelhos utilizando iontoforese foi estudada por Frucht-Pery et al(21). Neste estudo, discos de hidrogel contendo sulfato de gentamicina foram montados no eletrodo de iontoforese. Os resultados mostraram que a taxa de penetração de gentamicina na córnea foi influenciada pela intensidade da corrente e/ou pela duração da iontoforese.
Em pesquisa realizada em bancos de dados de patentes de referência, tais como o Brasil. Instituto Nacional da Propriedade Industrial - INPI -(32), o "United States Patent and Trademark Office"(33), o "Delphion Research Intellectual Property Network"(34), o "European Patent Office"(35) e o "The Intellectual Property Digital Library Web"(36), foram encontradas 13 patentes que descrevem a utilização da iontoforese no transporte ocular de drogas. Por exemplo, a patente US 6,154,671 intitulada "Dispositivo de transferência de pelo menos um produto ativo no interior do globo ocular humano por meio de iontoforese" descreve um sistema em forma de anel para transferência de pelo menos uma droga para o interior do bulbo ocular por meio de iontoforese. Esse dispositivo compreende um reservatório contendo a droga que pode ser aplicado sobre o olho de um paciente(37). Tal reservatório apresenta um eletrodo ativo de superfície colocado frente a frente com um tecido ocular situado na periferia da córnea e também um eletrodo de retorno colocado em contato com as pálpebras parcialmente fechadas do paciente. Uma corrente constante de 400 µA é aplicada por 4 minutos, o que torna a penetração da droga uniforme na região a ser tratada.
A patente US 6,697,668 intitulada "Sistema iontoforético ocular e método de utilização do mesmo" descreve um sistema de iontoforese ocular para o transporte de um interferon para uma região afetada do olho(38). Este sistema é composto por um eletrodo ativo associado a uma matriz, a qual contém um interferon capaz de tratar condições virais, imunorregulatórias e/ou de neovascularização. A corrente utilizada é ajustada para valores entre 0,5 e 4,0 µA, por um período entre 5 e 20 minutos. O método desta invenção compreende a associação do interferon com uma matriz do sistema de iontoforese, a associação do sistema de iontoforese ocular com o olho do paciente, o transporte de quantidades efetivas do interferon para a área afetada e o tratamento da área afetada do paciente, reduzindo ou eliminando os efeitos de condições virais, imunorregulatórias e/ou de neovascularização.
PERSPECTIVAS
Diferentes propostas de tratamento utilizando a iontoforese têm sido avaliadas, entre elas a prevenção de efeitos adversos relacionados ao uso de corticosteróides; o aumento da concentração local de antibióticos e a redução de seus efeitos adversos; o transporte para o local desejado de drogas contra citomegalovírus; a redução de infecções fúngicas; o controle da degeneração macular pelo transporte de agentes anti-angiogênicos diretamente para os neovasos da retina e pela terapia gênica por meio do transporte de oligonucleotídeos para as células retinianas; o controle da retinopatia diabética pelo bloqueio do início da reação de cadeia que leva à neovascularização, por meio da introdução de oligonucleotídeos no núcleo das células; o tratamento de retinoblastomas pelo transporte de carboplatina(22).
Um estudo clínico de fase III, em realização na França e nos Estados Unidos, que objetiva avaliar a eficácia da técnica de iontoforese no transporte de um corticosteróide para o tratamento de inflamações oculares, encontra-se em andamento. Centenas de pacientes com doenças inflamatórias graves, tais como uveíte, endoftalmite e edema macular foram tratados com sucesso utilizando esta técnica. Um outro estudo clínico, que ainda se encontra no início, visa o tratamento de edema macular(22).
O papel da iontoforese no campo da oftalmologia está sendo constantemente redefinido. Esta técnica, a julgar pelos estudos em andamento, terá importância como sistema de transporte local de drogas que não penetram facilmente na região intra-ocular e que requerem administrações repetidas por um longo período utilizando diferentes vias, as quais apresentam inconvenientes.
A iontoforese pode ser considerada como um método não-invasivo e não traumático designado para promover uma ampla penetração e transporte intra-ocular de drogas(18). Baseada na aplicação de uma corrente elétrica contínua de baixa intensidade, ela abre novas possibilidades de tratamento de doenças do segmento posterior do olho. A aplicação clínica da técnica aqui descrita, como um meio de aumentar a penetração ocular de drogas e atingir tecidos específicos do olho, pode promover a obtenção de índices terapêuticos adequados de drogas visando o tratamento de diferentes doenças oculares e minimizando complicações indesejáveis dos métodos de tratamento atualmente disponíveis.
REFERÊNCIAS
1. Sarraf D, Lee DA. The role of iontophoresis in ocular drug delivery. J Ocul Pharmacol. 1994;10(1):69-81.
2. Kalia YN, Naik A, Garrison J, Guy RH. Iontophoretic drug delivery. Adv Drug Deliv Rev. 2004;56(5):619-58.
3. Gangarosa LP Sr, Hill JM. Modern iontophoresis for local drug delivery. Int J Pharm. 1995;123(2):159-71.
4. Lai PM, Roberts MS. Iontophoresis. In: Roberts MS, Walters KA, editors. Dermal absorption and toxicity assessment. New York: Marcel Dekker; 1998. p.371-414.
5. Leduc S. Introduction des substances medicamenteuses dans la profondeur des tissues par le courant electrique. Ann Electrobiol. 1900;3:545-60.
6. Harris R. Iontophoresis. In: Licht S, editor. Therapeutic electricity and ultraviolet radiation. Baltimore: Waverly Press; 1967. p.156-78.
7. Gibson LE, Cooke RE. A test for concentration of electrolytes in sweat in cystic fibrosis of the pancreas utilizing pilocarpine by iontophoresis. Pediatrics. 1959; 23(3):545-9.
8. Murray W, Lavine LS, Seifter E. The iontophoresis of C21 esterified glucocorticoids: preliminary report. J Am Phys Ther Assoc. 1963;43(4):579-81.
9. Comeau M, Brummett R, Vernon J. Local anesthesia of the ear by iontophoresis. Arch Otolaryngol. 1973;98(2):114-20.
10. Gangarosa LP. Iontophoresis for surface local anesthesia. J Am Dent Assoc. 1974;88(1):125-8.
11. Gangarosa LP, Park NH. Practical considerations in iontophoresis of fluoride for desensitizing dentin. J Prosthet Dent. 1978;19(2):173-8.
12. Gangarosa LP, Hill JM, Thompson BL, Leggett C, Rissing JP. Iontophoresis of vidarabine monophosphate for herpes orolabialis. J Infect Dis. 1986;154 (6):930-4.
13. Rigano W, Yanik M, Barone FA, Baibak G, Cislo C. Antibiotic iontophoresis in the management of burned ears. J Burn Care Rehabil. 1992;13(4):407-9.
14. Jones RF, Maurice DM. New methods of measuring the rate of aqueous flow in man with fluorescein. Exp Eye Res. 1966;5(3):208-10.
15. Hughes L, Maurice D. A fresh look at iontophoresis. Arch Ophthalmol. 1984; 102(12):1825-9.
16. Behar-Cohen F, Parel JM, Pouliquen Y, Thillaye-Goldenberg B, Goureau O, Heydolph S, et al. Iontophoresis of dexamethasone in the treatment of endotoxin-induced-uveitis in rats. Exp Eye Res. 1997;65(4):533-45.
17. Behar-Cohen F, Savoldelli M, Parel JM, Goureau O, Thillaye-Goldenberg B, Courtois Y, et al. Reduction of corneal edema in endotoxin-induced-uveitis after application of L-NAME as nitric oxide synthase inhibitor in rats by ion-tophoresis. Invest Ophthalmol Vis Sci. 1998;39(6):897-904.
18. Behar-Cohen F, El Aouni A, Le Rouic JF, Parel JM, Renard G, Chauvaud D. Iontophoresis: past and future. J Fr Ophtalmol. 2001;24(3):319-27.
19. Behar-Cohen F. Drug delivery systems to target the anterior segment of the eye: fundamental bases and clinical applications. J Fr Ophtalmol. 2002;25(5): 537-44.
20. Monti D, Saccomani L, Chetoni P, Burgalassi S, Saettone MF. Effect of iontophoresis on transcorneal permeation 'in vitro' of two b-blocking agents, and on corneal hydration. Int J Pharm. 2003;250(2):423-9.
21. Frucht-Pery J, Mechoulam H, Siganos CS, Ever-Hadani P, Shapiro M, Domb A. Iontophoresis - gentamicin delivery into the rabbit cornea, using a hydrogel delivery probe. Exp Eye Res. 2004;78(3):745-9.
22. Optis Ocular Drug Delivery [text on the Internet]. [cited 2004 Aug 24]. Available from: http://www.optisgroup.com/Technology_Applications.htm
23. Callegan MC, Hobden JA, O'Callaghan RJ, Hill JM. Ocular drug delivery: a comparison of transcorneal iontophoresis to corneal collagen shields. Int J Pharm. 1995;123(2):173-9.
24. Sanderson JE, De Riel S, Dixon R. Iontophoretic delivery of non-peptide drugs: formulation optimisation for maximum skin permeability. J Pharm Sci. 1989;78(5):361-4
25. Barza M, Peckamn C, Baum J. Transscleral iontophoresis of gentamicin in monkeys. Invest Ophthalmol Vis Sci. 1987;28(6):1033-6.
26. Asahara T, Shinomiya K, Naito T, Shiota H. Induction of gene into the rabbit eye by iontophoresis: preliminary report. Jpn J Ophthalmol. 2001;45(1):31-9.
27. Behar-Cohen FF, El Aouni A, Gautier S, David G, Davis J, Chapon P. Transscleral Coulomb-controlled iontophoresis of methyl-prednisolone into the rabbit eye: influence of duration of treatment, current intensity and drug concentration in ocular tissues and fluids levels. Exp Eye Res. 2002;74(1):51-9.
28. Voigt M, de Kozak Y, Halhal M, Courtois Y, Behar-Cohen F. Down-regulation of NOSII gene expression by iontophoresis of anti-sense oligonucleotide in endotoxin-induced uveitis. Biochem Biophys Res Commun. 2002;295(2):336-41.
29. Vollmer DL, Szlek MA, Kolb K, Lloyd LB, Parkinson TM. In vivo transscleral iontophoresis of amikacin to rabbit eyes. J Ocul Pharmacol Ther. 2002; 18(6):549-58.
30. Berdugo M, Valamanesh F, Andrieu C, Klein C, Benezra D, Courtois Y, et al. Delivery of antisense oligonucleotide to the cornea by iontophoresis. Antisense Nucleic Acid Drug Dev. 2003;13(2):107-14.
31. Parkinson TM, Ferguson E, Febbraro S, Bakhtyari A, King M, Mundasad M. Tolerance of ocular iontophoresis in healthy volunteers. J Ocul Pharmacol Ther. 2003;19(2):145-51.
32. Brasil. Ministério do Desenvolvimento, Indústria e Comércio Exterior. Instituto Nacional da Propriedade Industrial [texto na Internet]. [citado 2004 Ago 24]. Disponível em: http://www.inpi.gov.br
33. United States. United States Patent and Trademark Office [text on the Internet]. [cited 2004 Aug 24]. Available from:http://www.uspto.gov/patft/index.html
34. United States. Delphion Research Intellectual Property Network [text on the Internet]. [cited 2004 Aug 24]. Available from: www.delphion.com
35. European Patent Office [text on the Internet].[cited 2004 Aug 24]. Available from: http://ep.espacenet.com
36. The Intellectual Property Digital Library Web[text on the Internet]. [cited 2004 Aug 24]. Available from: http://www.wipo.int/ipdl/en/index.jsp
37. Parel J, Behar-Cohen F, inventors. Device for the intraocular transfer of active products by iontophoresis. United States patent US 6,154,671;2000.
38. Parkinson TM, Szlek M, Lloyd LB, inventors. Ocular iontophoretic device and method for using the same. United States patent US 6,697,668;2004.
Endereço para correspondência
Universidade Federal de Minas Gerais - Faculdade de Farmácia
Avenida Antônio Carlos, 6627 - Campus UFMG
Belo Horizonte (MG) CEP 31270-010
E-mails: [email protected], [email protected]
* Wirtz (1908) apud(1)