

Fernanda Bon Duarte1; Rejane Carvalho Aires3; Fernando Mutton3; Augusto Paranhos Jr.4
DOI: 10.1590/S0004-27492003000700006
RESUMO
OBJETIVO: Verificar existência de alteração funcional das células magnocelulares por meio da tecnologia de freqüência duplicada (FDT), após o incremento de pressão gerado pela técnica de "laser assisted in situ keratomileusis" (LASIK), e avaliar os benefícios de realizar este em pacientes candidatos à cirurgia refrativa, considerando-se os custos envolvidos nos procedimentos. MÉTODOS: Estudo prospectivo em 19 pacientes com ametropias, submetidos à cirurgia "laser assisted in situ keratomileusis", no Hospital Oftalmológico de Sorocaba. Foram realizados 2 exames de tecnologia de freqüência duplicada em ambos os olhos dos pacientes antes da cirurgia por "laser assisted in situ keratomileusis", e um exame após a cirurgia. A avaliação da diferença entre as medidas de MD ("mean deviation") e PSD ("pattern standard deviation") efetuadas pela tecnologia de freqüência duplicada antes e depois da cirurgia refrativa foram avaliadas por meio do teste de t pareado. A diferença entre as medidas de MD (Delta MD) foi considerada variável dependente para elaborações de uma avaliação de regressão múltipla. Foi realizada uma análise de custos do exame de tecnologia de freqüência duplicada e da cirurgia "laser assisted in situ keratomileusis". RESULTADOS: Não houve diferença entre as medidas de MD no exame de tecnologia de freqüência duplicada antes e após o procedimento (p= 0,4454) assim como para PSD (p= 0,9716). Nenhuma variável contínua testada influiu significantemente no Delta MD (r²= 4,1%; F= 0,15; p= 0,960). Considerando a realização de 1500 cirurgias de "laser assisted in situ keratomileusis" ao ano no Hospital Oftalmológico de Sorocaba, o custo médio desta cirurgia é de R$ 373,27 e o custo do exame de tecnologia de freqüência duplicada é de R$ 13,15 por paciente. CONCLUSÕES: Não houve diferença estatisticamente significante entre as medidas de MD no exame de tecnologia de freqüência duplicada antes e após o procedimento assim como para PSD. A tecnologia de freqüência duplicada, exame com alta sensibilidade e especificidade, e de baixo custo poderia ser utilizado como exame pré-operatório em pacientes submetidos à cirurgia refrativa (LASIK), de alto custo, com o propósito de evitar tal procedimento em pacientes com glaucoma.
Descritores: Ceratomileuse assistida por excimer laser in situ; Análise custo-benefício; Erros de refração; Células ganglionares da retina; Perimetria
ABSTRACT
PURPOSE: To check if there is functional damage to magnocellular cells using the frequency doubling technology (FDT), after laser assisted in situ keratomileusis-LASIK intraocular pressure increase and to analyze the benefit of this test in patients undergoing refractive surgery, regarding involved costs. METHODS: Prospective study in 19 ametropic patients undergoing refractive laser assisted in situ keratomileusis surgery, at the "Hospital Oftalmológico de Sorocaba". Two frequency doubling technology examinations were performed in both eyes of patients before LASIK and one examination was done after the surgery. The assessment of the difference between the measurements of MD (Delta MD) was considered the dependent variable to formulate an evaluation of multiple regression. The costs of the frequency doubling technology and LASIK were analyzed. RESULTS: There was no difference between the MD (mean deviation) and PSD (pattern standard deviation) before and after the procedure (p= 0.4454 and p= 0.9716, respectively). The continuous variables did not significantly influence Delta MD (r²= 4.1%; F= 0.15; p= 0.96). We considered 1500 LASIK surgeries during one year at the "Hospital Oftalmológico de Sorocaba", and the average cost of this surgery is R$ 373.27. The frequency doubling technology costs R$ 13.15 for each patient. CONCLUSIONS: There was no statistically significant difference between MD and PSD (pattern standard deviation) before and after the surgery. The frequency doubling technology has high sensitivity and specificity and low cost, so it could be used in patients undergoing refractive surgery (high cost) to avoid the laser assisted in situ keratomileusis in glaucoma patients.
Keywords: Laser assisted in situ keratomileusis; Cost -benefit analysis; Refractive errors; Retinal ganglion cells; Perimetry
INTRODUÇÃO
A orbitopatia de Graves (OG) pode ser definida como uma doença auto-imune órgão-específica, clinicamente caracterizada por retração palpebral superior e/ou inferior, proptose e estrabismo(1-2). Na grande maioria dos casos a OG está associada ao hipertireoidismo decorrente do bócio difuso tóxico(3-4) sendo, portanto, uma das principais manifestações da doença de Graves, descrita na literatura européia no século XIX por Flajani, Parry, Graves e Basedow(5). Embora ocorra mais freqüentemente em mulheres adultas entre 30 e 50 anos de idade, a OG pode acometer pacientes de ambos sexos de diferentes faixas etárias, incluindo neonatos, crianças e adultos acima de cinqüenta anos de idade(1,4,6). Na população adulta, a OG é a causa mais comum de proptose, uni ou bilateral(1).
As principais estruturas orbitárias envolvidas no complexo processo auto-imune da doença são os músculos extra-oculares e o tecido adiposo, ambos passíveis de avaliação por exames de imagem como a ultra-sonografia, ressonância nuclear magnética e a tomografia computadorizada(7-8). O aumento das dimensões da musculatura extraocular é um achado freqüente, podendo variar desde um incremento mínimo de alguns músculos, até enorme alargamento de todos os músculos, especialmente os retos medial e inferior(9). Além de estrabismo restritivo, a hipertrofia muscular está fortemente associada à neuropatia óptica, que é uma das mais temidas complicações da OG, pelo risco de deficiência visual grave e permanente(10).
O objetivo deste trabalho é descrever uma paciente com neuropatia óptica bilateral e amaurose no olho direito há 20 dias devido a OG, que teve completa recuperação da acuidade visual em ambos os olhos após cirurgia descompressiva.
RELATO DE CASO
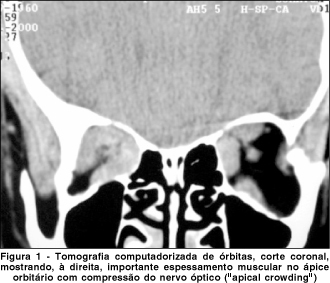
RSP, 33a, feminina, portadora de doença de Graves com orbitopatia há 1 ano. Fazia uso de propiltiuracil (100 mg/dia) e estava descontinuando um esquema de corticoterapia sistêmica (usava prednisona 20 mg/dia). No momento do exame oftalmológico estava com os hormônios tireoidianos normalizados. Referia perda visual progressiva em ambos os olhos há 9 meses e há 20 dias perda total da visão em OD. O exame oftalmológico mostrava retração palpebral superior em ambos os olhos e moderada proptose (exoftalmometria de Hertel 28 mm em OD e 26 mm em OE). O segmento anterior, fundoscopia e pressão intra-ocular eram normais. O exame dos reflexos pupilares revelava defeito pupilar aferente em OD (sinal de Marcus Gunn). A acuidade visual do olho esquerdo era igual a 0,5. No olho direito não havia percepção luminosa. A tomografia computadorizada de órbitas revelou importante espessamento muscular bilateral, com compressão do nervo óptico no ápice orbitário ("apical crowding") à direita (Figura 1). Devido à gravidade do quadro do olho direito, foi imediatamente indicado tratamento cirúrgico descompressivo. Outros testes psicofísicos como campimetria computadorizada e visão de cores, não foram realizados no olho esquerdo antes da cirurgia.
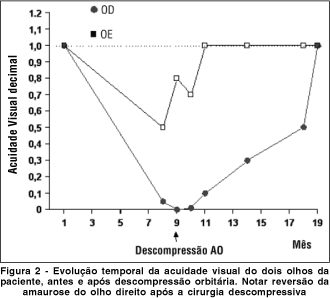
A paciente foi submetida à descompressão orbitária bilateral, por via transconjuntival ínfero-medial bilateral. A técnica usada combinava o acesso para o soalho(11-12) com a abordagem transcaruncular(13). Após a cirurgia a paciente evoluiu, com restabelecimento paulatino da visão em ambos os olhos. Dez meses após a cirurgia a visão era 20/20 em ambos em olhos e 1 ano após, a campimetria revelava no OD apenas uma perda generalizada da sensibilidade [desvio médio (MD) de -5,72 dB, p < 0,005], sendo normal no olho esquerdo.
DISCUSSÃO
A neuropatia óptica da OG é diagnosticada através de exames psicofísicos clássicos, dentre os quais os principais são a campimetria, e os estudos do sentido cromático e da sensibilidade ao contraste(14-18). A medida da acuidade visual não é considerada um exame sensível para a detecção da neuropatia óptica da OG(18) e, dessa maneira, déficits de acuidade visual são interpretados como indicadores de grave perda visual.
Não existem muitas opções para o tratamento da neuropatia óptica da OG. Se ela ocorre num contexto de orbitopatia aguda, isto é, acompanhada de sinais flogísticos (quemose, edema palpebral, hiperemia conjuntival) e sintomas como dor e lacrimejamento, a modalidade inicial de tratamento é o clínico com drogas imunossupressoras (esteróides sistêmicos) e radioterapia orbitária. Já nos casos crônicos ou não responsivos ao tratamento clínico, a descompressão orbitária é a única opção viável(19-20).
A descompressão orbitária é um procedimento cirúrgico que atua na relação continente/conteúdo da órbita. Na maioria dos casos, a cirurgia visa o aumento das dimensões orbitárias por meio da remoção de porções ou, até mesmo, partes inteiras das paredes orbitais(21). Quando o continente orbitário é aumentado, a pressão intra-orbitária é reduzida e o seu conteúdo é mais bem acomodado. Esses dois efeitos explicam a melhora das funções visuais nos casos de neuropatia óptica da OG após descompressões bem sucedidas.
O resultado cirúrgico mais valorizado é o aumento das dimensões do ápice orbitário. Levando-se em conta que o principal mecanismo aventado para a perda visual na OG é a compressão do nervo óptico no ápice orbitário pela musculatura alargada ("apical crowding")(22), é fácil aceitar a noção de que a descompressão orbitária pode realmente beneficiar os pacientes com neuropatia óptica por doença de Graves.
Embora, não haja um consenso do ganho visual que se consegue com a cirurgia, a melhoria das funções visuais após a descompressão orbitária é bem documentada na literatura(19-20). De uma maneira geral, pode-se dizer que déficits campimétricos periféricos são bem revertidos cirurgicamente. O caso em questão difere dos já apresentados na literatura(19-20), pela magnitude da melhora da acuidade visual conseguida com a descompressão, pois não temos conhecimento de nenhum caso publicado de amaurose por OG completamente revertida após a cirurgia descompressiva.
Em resumo, o caso relatado indica que, na neuropatia óptica da OG, o nervo óptico pode ter função restabelecida pela cirurgia descompressiva mesmo após 20 dias de amaurose.
REFERÊNCIAS
1. Burch HB, Wartofsky L. Graves' ophthalmopathy: current concepts regarding pathogenesis and management. Endocr Rev 1993;14:747-93.
2. Bahn RS, Heufelder AE. Pathogenesis of Graves' ophthalmopathy. N Engl J Med 1993;329:1468-75.
3. Bartley GB, Gorman CA. Diagnostic criteria for Graves' ophthalmopathy. Am J Ophthalmol 1995;119:792-5.
4. Bartley GB, Fatourechi V, Kadrmas EF, Jacobsen SJ, Ilstrup DM, Garrity JA, Gorman CA. Chronology of Graves' ophthalmopathy in an incidence cohort. Am J Ophthalmol 1996;121:426-34.
5. Sawin CT. Theories of causation of Graves'disease. Endocrinol Metab Clin North Am 1998;27:63-72.
6. Kendler DL, Lippa J, Rootman J. The initial clinical characteristics of Graves' orbitopathy vary with age and sex. Arch Ophthalmol 1993;111:197-201.
7. Feldon SE, Lee CP, Muramatsu SK, Weiner JM. Quantitative computed tomography of Graves' ophthalmopathy. Extraocular muscle and orbital fat in development of optic neuropathy. Arch Ophthalmol 1985;103:213-5.
8. Barrett L, Glatt HJ, Burde RM, Gado MH. Optic nerve dysfunction in thyroid eye disease: CT?. Radiology 1988;167:503-7.
9. Feldon SE, Weiner JM. Clinical significance of extraocular muscle volumes in Graves' ophthalmopathy: a quantitative computed tomography study. Arch Ophthalmol 1982;100:1266-9.
10. Feldon SE, Muramatsu S, Weiner JM. Clinical classification of Graves' ophthalmopathy. Identification of risk factors for optic neuropathy. Arch Ophthalmol 1984;102:1469-72.
11. McCord CD. Orbital decompression for Graves' disease. Exposure through lateral canthal and inferior fornix incision. Ophthalmology 1981;88:533-41.
12. Shore JW. The fornix approach to the inferior orbit. Adv Ophthalmic Plast Reconstr Surg 1987;6:377-85.
13. Shorr N, Baylis HI, Goldberg RA, Perry JD. Transcaruncular approach to the medial orbit and orbital apex. Ophthalmology 2000;107:1459-63.
14. Drucker MD, Savino PJ, Sergott RC, Bosley TM, Schatz NJ, Kubilis PS. Low-contrast letter charts to detect subtle optic (corrected) neuropathies. Am J Ophthalmol 1988;105:141-5.
15. Hedges TR Jr, Scheie HG. Visual field defects in exophthalmos associated with thyroid disease. Ama Arch Ophthalmol 1955;54:885-92.
16. Trobe JD. Optic nerve involvement in dysthyroidism. Ophthalmology 1981; 88:488-92.
17. Mourits MP, Suttorp-Schulten MS, Tijssen RO, Apkarian P. Contrast sensitivity and the diagnosis dysthyroid optic neuropathy. Doc Ophthalmol 1990; 74:329-35.
18. Suttorp-Schulten MS, Tijssen R, Mourits MP, Apkarian P. Contrast sensitivity function in Graves' ophthalmopathy and dysthyroid optic neuropathy. Brit J Ophthalmol 1993;77:709-12.
19. Trobe JD, Glaser JS, Laflamme P. Dysthyroid optic neuropathy. Clinical profile and rationale for management. Arch Ophthalmol 1978;96:1199-209.
20. Carter KD, Frueh BR, Hessburg TP, Musch DC. Long-term efficacy of orbital decompression for compressive optic neuropathy of Graves' eye disease. Ophthalmology 1991;98:1435-42.
21. Velasco e Cruz AA, Guimarães FC, Mauad A. Descompressão orbital no tratamento da orbitopatia distireoidiana. Arq Bras Oftalmol 1996;59:62, 64-8.
22. Neigel JM, Rootman J, Belkin RI, Nugent RA, Drance SM, Beattie CW, et al. Dysthyroid optic neuropathy. The crowded orbital apex syndrome. Ophthalmology 1988;95:1515-21.
Endereço para correspondência
Antonio Augusto Velasco e Cruz
Departamento de Oftalmologia, Otorrinolaringologia e Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP - Hospital das Clínicas - Campus
Av. Bandeirantes, 3900
Ribeirão Preto (SP) CEP 14049-900
E-mail: [email protected]
Recebido para análise em 18.04.2002
Versão revisada recebida em 28.01.2003
Aprovação em 09.05.2003
Trabalho realizado no Departamento de Oftalmologia, Otorrinolaringologia e Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto – Universidade de São Paulo – USP.
Nota Editorial: Pela análise deste trabalho e por sua anuência na divulgação desta nota, agradecemos ao Dr. Alexandre Chater Taleb.