

Nelson Maimone; Aline Leonel Maimone
DOI: 10.1590/S0004-27492001000600009
RESUMO
Objetivo: Avaliar a eficácia de um produto usado habitualmente para limpeza de lentes de contato (CompleteÒ: poliexametileno de biguanida (TrisChemTM), tiloxapol, trometamina e EDTA em solução isotônica estéril) na desinfecção do cone do tonômetro de aplanação. Métodos: O cone permaneceu imerso na solução no período médio de 28 minutos. Foi utilizado um recipiente para limpeza de lentes de contato e um suporte de isopor. Ao final de cada dia, durante 22 dias, foram realizadas culturas para fungos e bactérias, exames diretos para fungos e bacterioscopia por Gram. Foi testado "in vitro" o poder bactericida e fungicida do produto para S. aureus ATCC#25923, E. coli ATCC#25922, P. aeruginosa ATCC#27853, C. albicans ATCC# 76615, A. niger ATCC#16404. Resultados: Nas culturas, nos exames diretos para fungos e nas bacterioscopias por Gram não foram identificados microrganismos. No estudo "in vitro", foram necessárias 48 horas para eliminação completa de todas cepas estudadas. Conclusão: Não foram encontradas bactérias e fungos em todos exames realizados da solução e recipiente. No entanto, os testes "in vitro" demonstraram que o tempo de imersão do cone na solução (média de 28 minutos) é insuficiente para eliminação completa dos microrganismos, o que inviabiliza o uso desse produto na desinfecção do cone plástico do tonômetro de aplanação.
Descritores: Tonometria; Desinfecção; Contaminação de equipamentos; Desinfetantes
ABSTRACT
Purpose: To evaluate the efficacy of a product which is normally used for cleaning of contact lenses (CompleteÒ: polyhexamethylene biguanide (Tris ChemTM), Tyloxapol, USP, Tromethamine, USP, and Edetate disodium, USP, in sterile isotonic solution) in the disinfection of the cone of the applanation tonometer. Methods: The cone remained immersed in the solution for an average period of 28 minutes. A container for cleaning the contact lenses and a polystyrene support were used. At the end of each day, for 22 days, cultures for fungi and bacteria were carried out as well as direct examinations for fungi and Gram bacterioscopies for S. aureus. The bactericide and fungicide power of the product for S. aureus ATCC#25923, E. coli ATCC#25922, P. aeruginosa ATCC#27853, C. albicans ATCC#76615 and A. niger ATCC# 16404 was verified in vitro. Results: In the cultures, in the direct examination for fungi and in the bacterioscopy by Gram, microorganisms were not identified. In the study in vitro, 48 hours were necessary for the complete elimination of all studied bacteria. Conclusions: Bacteria and fungi were not found in any of the examinations carried out in the solution and in the receptacle despite the fact that the tests in vitro had demonstrated that the time of immersion of the head in the solution (average of 28 minutes) was insufficient for the complete elimination of the microorganisms, what makes the use of this product impractical in the disinfection of the plastic cone of the applanation tonometer.
Keywords: Tonometry; Disinfection; Equipment contamination; Disinfectants
INTRODUÇÃO
O cone plástico do tonômetro de aplanação de Goldmann é potencialmente contaminado. Isto ocorre devido ao contato do cone plástico com olho do paciente e pelas medicações tópicas usadas em sua técnica. No saco conjuntival pode haver bactérias e fungos(1-3).
A técnica original da tonometria de aplanação descrita por Goldmann e Schimdt* em 1957 recomenda o uso de fluoresceína (citado por Moses, 1960)(4). Estudos demonstraram que as soluções de fluoresceína podem estar contaminadas por P. aeruginosa(5). Para alguns autores o uso da fluoresceína é opcional, sendo usado somente nos casos em que há dúvidas nos resultados(6).
Muitos produtos são recomendados para desinfecção do cone plástico do tonômetro de aplanação de Goldmann, como álcool isopropílico a 70%, peróxido de hidrogênio e hipoclorito de sódio(7-9). O Centro de Moléstias Infecciosas de Atlanta e a Academia Americana de Oftalmologia recomendam que o cone seja imerso de 5 a 10 minutos em peróxido de hidrogênio a 3% ou hipoclorito de sódio a 0,5%(10).
O objetivo deste trabalho é avaliar a eficácia de um produto para desinfecção do cone do tonômetro, utilizando-se um recipiente que padroniza o volume do mesmo em contato com o cone plástico do tonômetro. Este produto é habitualmente indicado como limpador e surfactante para enxágüe e armazenamento de lentes de contato hidrofílicas.
MÉTODOS
O estudo foi realizado no período de 01/08/1995 a 31/08/1995. Foram examinados 235 pacientes, sendo realizadas um total de 468 tonometrias durante 22 dias, em média 21 por dia, utilizando-se sempre a mesma solução, a qual era renovada no dia seguinte. O intervalo em média, entre as tonometrias para cada paciente foi de 28 minutos. Utilizou-se anestesia tópica com colírio de cloridrato de proximetacaína, sem o uso de fluoresceína.
Foram excluídos pacientes portadores ou com suspeita de doenças oculares externas, infecciosas e inflamatórias. Como recipiente foi utilizado um frasco de plástico (usado para remoção de proteínas de lentes de contato), onde o cone plástico permanecia imerso na solução somente 3 mm a partir do ápice de seu prisma durante o intervalo entre os exames. Foi confeccionado um suporte de isopor para que o cone não fosse desconectado do tonômetro (Figura 1).

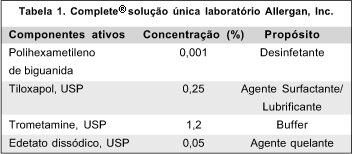
Ao início de cada dia, esse recipiente foi esterilizado por imersão em Sterilabor durante 30 minutos e a seguir lavado com soro fisiológico a 0,9% estéril. Sterilabor contém: 1) componentes ativos: cloreto de alquil benzil amônio (0,20 g), nonil fenoxi polietox etanol (0,80 g), formaldeído 40% (2,70 g), álcool etílico (54 ml); 2) componentes inertes seqüestrantes, antioxidantes, corantes e água deionizada q.s.p. 100 ml. No recipiente de 10 ml eram colocadas somente 5 ml da solução de Complete® (Tabela 1), suficiente para permanecer imersa somente a cabeça do cone plástico, sem contato do mesmo com as paredes internas do recipiente, previamente esterilizado com Sterilabor para evitar a sua contaminação. Desta forma, também se protegiam as marcas do prisma pelo contato com a solução, a qual poderia apagá-las. (Figura 1). Antes de cada tonometria o cone era enxugado com lenço de papel, sendo novamente imerso na solução ao término do exame. Ao final de cada dia, eram aspirados 5 ml da solução do recipiente com seringa estéril e encaminhados para cultura e exame direto de microorganismos.
No final de cada dia foram realizadas culturas da solução do recipiente contendo o Complete®, num total de 22 dias, para fungos e bactérias aeróbicas. Para bactérias os meios utilizados foram colúmbia ágar base (P. aeruginosa), sal de manitol fenol vermelho ágar base (S. aureus), BEM: ágar e monohidrato de lactose (enterococos), colocados a 37º C, com observação após 24 e 48 horas. Para fungos utilizou-se como meio de cultura Sabouraud 4% dextrose ágar, com observação após 30 dias. Também foram realizados exames diretos da lâmina para fungos e bacterioscopias por Gram durante os 22 dias.
Para as bactérias anaeróbias foram feitas 4 pesquisas, realizadas em sistema automatizado Bactec 9240, com leitura por fluorescência para líquidos e sangue, usado como meio de cultura caldo tríptico de soja enriquecido com aminoácidos.
Para verificação "in vitro" do poder bactericida e fungicida do produto utilizado na desinfecção do cone, foram testados os microorganismos: S. aureus ATCC# 25923, E. coli ATCC# 25922, P. aeruginosa ATCC#27853, C. albicans ATCC# 76615 e A. niger ATCC# 16404. Na primeira etapa, no preparo do inóculo, os microorganismos citados foram suspensos em caldo tríptico de soja enriquecido com aminoácidos (TSB) a partir de cultura em meio sólido: ágar sangue para bactérias e ágar Sabouraud-dextrose para fungos. Foi acertada a turvação pela escala 0,5 de McFarland: aproximadamente 1,5x108 UFC/mL. A seguir foi diluida a 1:100 em caldo TSB, para obter a "suspensão de trabalho". Na segunda etapa do teste, juntamos 0,1 mL da suspensão de trabalho, de cada microorganismo, a cinco tubos contendo 9,9 mL da solução em estudo e homogeneizamos. Os tubos foram deixados à temperatura ambiente e foram feitos repiques de 10 µL, com alça calibrada para placas contendo ágar neutralizante (D/E neutralizing Agar-Difco) e ágar Sabouraud-dextrose nos tempos: 1, 30, 60 minutos e 4, 24, 48 horas. Os repiques foram incubados à temperatura de 37°C para bactéias e 30 ºC para fungos. Foram feitas leituras após 24 e 48 horas para bactérias e leituras diárias por 15 dias para os fungos. Contamos o número de unidades formadoras de colônias (UFC) nas placas. No grupo controle, juntamos 0,1 mL da suspensão de trabalho em 9,9 mL de TSB e homogeneizamos. Foram feitos repiques de 10 mL com alça calibrada para ágar-sangue, ágar neutralizante e Sabouraud-dextrose. Incubamos por 24 horas a 37ºC para bactérias e contamos o número de UFC por placa. Incubamos por 15 dias, à temperatura de 30ºC, e contamos o número de UFC por placa.
Fórmula do ágar D/E Neutralizing Media (difco) utilizado neste trabalho:
O volume do inóculo, repicado após diferentes tempos de ação do desinfetante, foi de 10 µL para placas de Petri contendo 20 mL do D/E Neutralizing Agar. A técnica utilizada foi a de inoculação direta, pois o meio de cultura neutraliza o efeito do desinfetante testado.
Quanto à padronização do inóculo, foi utilizado 0,1 mL da suspensão inicial dos microorganismos em 9,9 mL da solução do Complete®, obtendo-se a seguinte concentração final de microorganismos:
RESULTADOS
Nas 22 amostras da solução na qual o cone plástico era imerso, não houve desenvolvimento de fungos, bactérias aeróbicas e anaeróbicas. Não foram observados microorganismos no exame direto da lâmina e pela coloração de Gram.
Não houve comprometimento da pele dos dedos do examinador pelo contato com o produto. Não se observou alterações do epitélio corneano ou conjuntiva dos pacientes examinados após cada tonometria, assim como não houve queixas dos mesmos. O cone plástico do tonômetro não foi danificado durante o período de exames (22 dias).
No estudo "in vitro", observando-se os resultados da tabela 2, o tempo necessário para eliminação total dos microorganismos após a exposição do produto foi de 60 minutos para E. coli e P. aeruginosa, 4 horas para S. aureus, 24 horas para C. albicans e 48 horas para A. Niger.
DISCUSSÃO
Pode haver bactérias e fungos na lágrima e fundo de saco conjuntival(1-3), tornando-se indispensável a adequada limpeza do tonômetro após seu uso. Neste estudo não utilizamos solução de fluoresceína devido seu risco de contaminação por P. aeruginosa(5). Em pacientes com o epitélio corneano íntegro, o uso do Complete® seria um fator coadjuvante associado às defesas naturais do filme lacrimal, na eliminação de microorganismos presentes no cone plástico dos tonômetros, da mesma forma, utilizando-se colírios anestésicos com preservativos e realizando as tonometrias sem fluoresceína(6). Entre as vantagens do uso do recipiente utilizado neste trabalho poderemos citar: a padronização do volume do Complete® (5 ml), proporcionando aproximadamente a mesma concentração do produto em contato com o cone plástico do tonômetro e o seu espaço interior ser de tal modo suficiente, evitando-se assim o toque do cone com suas paredes internas e possível contaminação. Há muito tempo é conhecido que a modificação na concentração do agente antimicrobiano, ou pH ou temperatura na qual é atuante, pode ter profunda influência na sua atividade(11).
O meio de cultura ágar D/E Neutralizing Media (Difco.) utilizado neste trabalho, neutraliza uma gama extensa de anti-sépticos e desinfetantes químicos, incluindo compostos de amônio quaternário (biguanidas, fenólicos, preparações iodadas e cloretadas, mercuriais, formaldeído, e glutaraldeido)(11). O componente deste meio que neutraliza o agente desinfetante do Complete® (biguanida) é uma mistura de Lecitina+Polisorbato 80. A diluição utilizada também tem efeito neutralizante para o EDTA, que faz parte da fórmula do produto testado(11). Existem outras técnicas para testar o poder de desinfetantes, tais como o de filtro millipore, através de carreadores, métodos da diluição, etc(11).
Muitos autores tentam desenvolver recipientes para imersão do cone do tonômetro com a finalidade de desinfetá-lo(12-14), procurando uma forma prática e econômica. Burkirk (1987) salientou a dificuldade e o tempo gasto com os métodos recomendados.
O uso de hipoclorito de sódio, peróxido de hidrogênio e álcool isopropílico causa perda do polimento exterior e das marcas dos eixos localizados no lado externo do cone plástico(15). A imersão de apenas 3 mm de sua extremidade distal em nosso recipiente impede que drogas como peróxido de hidrogênio e hipoclorito de sódio removam sua marcas.
As reações adversas do peróxido de hidrogênio são amplamente conhecidas devido sua utilização na limpeza de lentes de contato. A liberação de radicais livres causam danos ao epitélio e estroma corneano(16-17). Os sintomas e sinais descritos são de lacrimejamento, hiperemia, blefaroespasmo, edema, dores em ferroadas e queimadura leve nos dedos(16).
Opacidades corneanas foram relatadas após o uso do tonômetro desinfetado por peróxido de hidrogênio e álcool isopropílico a 70%, resultante da falha de remoção dos respectivos produtos(18-19).
Como se pode concluir, a maioria dos produtos recomendados pelo Centro de Moléstias Infecciosas de Atlanta pode acarretar complicações(15-19). Como foi demonstrado em nosso trabalho, não houve comprometimento do epitélio corneano ou conjuntiva em nossos pacientes e pele das mãos do examinador. Não houve queixas após as tonometrias, fatores positivos na escolha deste produto como meio de desinfecção dos cones plásticos. O intervalo médio entre as tonometrias foi de 28 minutos, o qual era insuficiente na eliminação dos microorganismos testados "in vitro" (Tabela 2), o que inviabilizaria o uso deste produto. No entanto, os testes "in vivo" não demonstraram a presença de microorganismos na solução e recipiente e os pacientes examinados não apresentavam comprometimento do segmento anterior.
CONCLUSÃO
Embora os teste "in vitro" tenham demonstrado que o tempo de imersão do cone (28 minutos) foi insuficiente para a eliminação completa dos microorganismos, não foram encontradas bactérias e fungos em todos exames realizados da solução e recipiente. Os testes realizados não inviabilizam a finalidade para qual o produto é indicado (lentes de contato). O recipiente descrito neste estudo padroniza o volume do Complete® (5 ml) em contato com o cone plástico, mantendo-se aproximadamente a mesma concentração do produto, o qual não deve ser utilizado para desinfecção dos cones plásticos dos tonômetros de aplanação, levando-se em consideração os resultados dos testes "in vitro".
AGRADECIMENTOS
Ao Prof. Dr. Carlos Augusto Moreira Jr. e Dr. Waldemar Francisco.
REFÊRENCIAS
1. Marcon AS, Barbosa MP, Vasques CL, Marcon IM, Dorneles IC, Kader ITA, et al. Microbiota aeróbia e anaeróbia da conjuntiva e borda palpebral de indivíduos hígidos. Arq Bras Oftalmol 1996;59:289-94.
2. Ando N, Takatori K. Fungal flora of the conjunctival sac. Am J Ophthalmol 1982;94:67-74.
3. Singer TR, Isenberg SJ, Apt L. Conjuntival anaerobic and aerobic bacterial flora in pediatric versus adult subject. Br J Ophthalmol 1988;72:448-51.
4. Moses RA. Fluorescein in applanation tonometry. Am J Ophthalmol 1960; 49:1149-55.
5. Vaughan DG. The contamination of fluorescein solutions with special reference to P. aeruginosa (bacillus pyocyaneus). Am J Ophthalmol 1955;39: 55-61.
6. Maimone N, Maimone AL. Tonometria de aplanação com e sem o uso de fluoresceína. Rev Bras Oftalmol 1995;54:21-5.
7. Ventura LM, Dix RD. Viability of herpes simplex virus type 1 on the applanation tonometer. Am J Ophthalmol 1987;103:48-52.
8. Pepose JS, Linette G, Lee SF, MacRae S. Disinfection of Goldmann tonometers against human immunodeficiency virus type 1. Arch Ophthalmol 1989; 107:983-5.
9. Su CS, BOowden S, Fong LP, Taylor HR. Current tonometer disinfection may be inadequate for hepatitis B virus. Arch Ophthalmol 1994;112:1406-7.
10. Van Buskirk EM. Disinfectant receptacle for applanation tonometers. Am J Ophthalmol 1987;104:307-8.
11. Russell AD. Factors influencing the efficacy of antimicrobial agents. In: Russel LAD, Hugo WB, Ayliffe GAJ, editors. Principles and practice of disinfection, preservation and sterilisation. Boston: Blackwell Scientific;1982. Cap. 3.
12. McLean CJ. A New Tonometer prism stand. Arch. Ophthalmol 1994;112: 685-6.
13. Vijfvinkel G, Jong PT. Disinfectant container for diagnostic lenses. Am J Ophthalmol 1985;99:600-1.
14. Machesney W., Salz JJ. A Simple, convenient tonometer tip disinfection technique. Ophthalmic Surg 1988;19:748-9.
15. Key CB, Whitman J. Alcohol soaking damages applanation tonometer heads. . Arch Ophthalmol 1986;104:800.
16. TripathI BJ, Tripathi RC. Hydrogen peroxide damage to human corneal epithelial cells in vitro. Implications for contact lens disinfection systems. Arch Ophthalmol 1989; 107:1516-9.
17. Lavery KT, Cowden JW, MacDermott ML. Corneal toxicity secondary to hydrogen peroxide-saturated contact lens. Arch. Ophthalmology 1991;109: 1352.
18. Pogrebniak AE, Sugar A. Corneal toxicity from hydrogen peroxide-soaked tonometer tips. Arch Ophthalmol 1988;106:1505.
19. Soukiasian SH, Asdourian GK, Weiss JS, Kachadoorian HA. A complication from alcohol-swabbed tonometer tips. Am J Ophthalmol 1988;105:424-5.
Trabalho realizado na Clínica de Olhos Santa Maria - Maringá - PR.
1 Médicos Oftalmologistas da Clínica de Olhos Santa Maria - Maringá - PR.
Os autores declaram não possuírem nenhum interesse comercial nas drogas ou equipamentos citados.
Endereço para correspondência: Nelson Maimone - Av. Brasil, 3.765 - 2o andar - Maringá (PR) CEP 87013-000. E-mail: [email protected]
* Goldmann, Schimdt (1957) apud Moses RA. Fluorescein in applanation tonometry. Am J Ophthalmol 1960;49:1149-55.