

Tulio Batista Abud1; Marcio Scuoteguazza Filho2; Edjane Souza Santos Oliveira2; Jorge Felipe Abud2; João Antonio Prata Junior3
DOI: 10.1590/S0004-27492013000200003
ABSTRACT
PURPOSE: To compare the hypotensive effect in normal eyes of three formulations with different concentrations of brimonidine tartrate: 0.2%; 0.15% and 0.1%. METHODS: Prospective, randomized, double-blind study included 60 volunteers, who underwent initial ophthalmologic examination and measurement of intraocular pressure (IOP). Individuals were divided into three groups: (1) brimonidine tartrate 0.15%, (2) brimonidine tartrate 0.2% and (3) brimonidine tartrate 0.1% and randomly received one drop each of drops in each eye. The IOP was measured after 30 minutes, 1 hour and 2 hours. RESULTS: We found that all concentrations of brimonidine tartrate significantly reduced intraocular pressure during the study period, with p<0.05. When analyzing the percentage difference of the hypotensive effect of each group, we found no significant difference between the studied groups: (1) -13.50%, (2) -11.50%, (3) -11.90% after 30 minutes (p=0.650); (1) -24.30%, (2) -18.60%, (3) -18.30% after 1 hour (p=0.324); (1) -29.14%, (2) -21.20%, (3) -25.60% after 2 hours (p=0.068). CONCLUSION: There is no statistically significant difference in intraocular pressure reduction (peak period) between the three formulations of brimonidine.
Keywords: Quinoxalines; Antihypertensive agents; Tonometry, ocular; Aqueous humor; Ophtalmic solutions; Comparative study
RESUMO
OBJETIVO: Comparar o efeito hipotensor a curto prazo das três formulações de colírio de tartarato de brimonidina, Alphagan®, Alphagan® P e Alphagan® Z em olhos normais. MÉTODO: Estudo prospectivo, randomizado, duplo-cego que contou com 60 voluntários, os quais foram submetidos a exame oftalmológico inicial e aferição da pressão intraocular (PIO). Os participantes foram distribuídos em três grupos: 1 tartarato de brimonidina 0,15%, 2 tartarato de brimonidina 0,2% e 3 tartarato de brimonidina 0,1%, aleatoriamente, cada um recebeu uma gota de colírio em cada olho e a pressão intraocular foi aferida após 30 minutos, 1 hora e 2 horas. RESULTADOS: Observou-se que todas as concentrações de tartarato de reduziram significativamente a pressão intraocular durante o tempo estudado, com p<0,05. Ao ser analisada a diferença percentual do efeito hipotensor de cada grupo, verificou-se que não há diferença significativa entre os colírios estudados: (1) -13,50%, (2) -11,50%, (3) -11,90% após 30 minutos (p=0,650); (1) -24,30%, (2) -18,60%, (3) -18,30% após 1 hora (p=0,324); (1) -29,14% (2) -21,20%, (3) -25,60% após 2 horas (p=0,068). CONCLUSÃO: Não há diferença estatisticamente significativa para redução da pressão intraocular (no período de pico) entre as três formulações de brimonidina.
Descritores: Quinoxalinas; Anti-hipertensivos; Pressão intraocular; Tonometria ocular; Humor aquoso; Soluções oftálmicas; Estudos comparativos
ARTIGO ORIGINAL ORIGINAL ARTICLE
Efeito hipotensor de três formulações diferentes do tartarato de brimonidina em olhos normais
Hypotensive effect of three different formulations of brimonidine tartrate in normal eyes
Tulio Batista AbudI; Marcio Scuoteguazza FilhoII; Edjane Souza Santos OliveiraII; Jorge Felipe AbudII; João Antonio Prata JuniorIII
IPhysician, Setor de Córnea e Cirurgia Refrativa, Hospital Oftalmológico de Sorocaba/Banco de Olhos de Sorocaba, Sorocaba (SP), Brazil
IIPhysician, Departamento de Oftalmologia, Universidade Federal do Triângulo Mineiro, Uberaba (MG), Brazil
IIIPhysician, Universidade Federal do Triângulo Mineiro, Uberaba (MG), Brazil
RESUMO
OBJETIVO: Comparar o efeito hipotensor a curto prazo das três formulações de colírio de tartarato de brimonidina, Alphagan®, Alphagan® P e Alphagan® Z em olhos normais.
MÉTODO: Estudo prospectivo, randomizado, duplo-cego que contou com 60 voluntários, os quais foram submetidos a exame oftalmológico inicial e aferição da pressão intraocular (PIO). Os participantes foram distribuídos em três grupos: 1 tartarato de brimonidina 0,15%, 2 tartarato de brimonidina 0,2% e 3 tartarato de brimonidina 0,1%, aleatoriamente, cada um recebeu uma gota de colírio em cada olho e a pressão intraocular foi aferida após 30 minutos, 1 hora e 2 horas.
RESULTADOS: Observou-se que todas as concentrações de tartarato de reduziram significativamente a pressão intraocular durante o tempo estudado, com p<0,05. Ao ser analisada a diferença percentual do efeito hipotensor de cada grupo, verificou-se que não há diferença significativa entre os colírios estudados: (1) -13,50%, (2) -11,50%, (3) -11,90% após 30 minutos (p=0,650); (1) -24,30%, (2) -18,60%, (3) -18,30% após 1 hora (p=0,324); (1) -29,14% (2) -21,20%, (3) -25,60% após 2 horas (p=0,068).
CONCLUSÃO: Não há diferença estatisticamente significativa para redução da pressão intraocular (no período de pico) entre as três formulações de brimonidina.
Descritores: Quinoxalinas; Anti-hipertensivos/administração & dosagem; Pressão intraocular; Tonometria ocular; Humor aquoso; Soluções oftálmicas; Estudos comparativos
ABSTRACT
PURPOSE: To compare the hypotensive effect in normal eyes of three formulations with different concentrations of brimonidine tartrate: 0.2%; 0.15% and 0.1%.
METHODS: Prospective, randomized, double-blind study included 60 volunteers, who underwent initial ophthalmologic examination and measurement of intraocular pressure (IOP). Individuals were divided into three groups: (1) brimonidine tartrate 0.15%, (2) brimonidine tartrate 0.2% and (3) brimonidine tartrate 0.1% and randomly received one drop each of drops in each eye. The IOP was measured after 30 minutes, 1 hour and 2 hours.
RESULTS: We found that all concentrations of brimonidine tartrate significantly reduced intraocular pressure during the study period, with p<0.05. When analyzing the percentage difference of the hypotensive effect of each group, we found no significant difference between the studied groups: (1) -13.50%, (2) -11.50%, (3) -11.90% after 30 minutes (p=0.650); (1) -24.30%, (2) -18.60%, (3) -18.30% after 1 hour (p=0.324); (1) -29.14%, (2) -21.20%, (3) -25.60% after 2 hours (p=0.068).
CONCLUSION: There is no statistically significant difference in intraocular pressure reduction (peak period) between the three formulations of brimonidine.
Keywords: Quinoxalines; Antihypertensive agents/administration & dosage Intraocular pressure; Tonometry, ocular; Aqueous humor; Ophtalmic solutions; Comparative study
INTRODUÇÃO
Desde o início do uso em 1996 da solução oftalmológica de tartarato de brimonidina 0,2% (Alphagan®; Allergan, Irvine, CA), este agonista adrenérgico seletivo alfa-2 provou ser um efetivo e seguro agente para controle a longo prazo do glaucoma e da hipertensão ocular(1,2). O mecanismo pelo qual esta droga reduz a pressão intraocular (PIO) é principalmente pela diminuição da produção de humor aquoso e em menor importância pelo aumento da drenagem uveoescleral(2,3). Sua eficácia quando usada duas vezes ao dia é comparada à do maleato de timolol 0,5%, sendo considerada uma efetiva opção para monoterapia, terapia adjuvante e de substituição(4-6). É ainda considerada eficaz na prevenção da elevação da PIO após aplicação de laser na câmara anterior, como demonstrado por Chen e Seong(7,8). Alguns efeitos colaterais oculares são mais frequentes quando comparados com outras drogas, como secura ocular, edema palpebral e sensação de ardor(9-11). Estudos mostraram menor risco de efeitos colaterais sistêmicos quando comparada com os beta-bloqueadores(4,9,10,12,13).
O colírio de tartarato de brimonidina 0,15% (Alphagan P®, Allergan, Irvine, CA) teve em sua fórmula a substituição do conservante cloreto de benzalcônio pelo Purite® (Allergan). O primeiro é o conservante antimicrobiano mais usado nas formulações tópicas oftalmológicas(14,15). Em altas concentrações é mais tóxico do que outros conservantes, podendo acumular por longos períodos nos tecidos oculares e induzir morte celular dose-dependente(16,17). Em contraste, Purite® (Allergan) é um microbicida com grande espectro antimicrobiano e muito baixo nível de toxicidade em células mamíferas(18). Quando exposto à luz, é convertido em componetes naturais da lágrima(19).
Além da troca do conservante o Alphagan P® (Allergan, Irvine, CA) teve uma redução de 25% de droga ativa em sua fórmula. Estudos em animais sugerem que a biodisponibilidade do tartarato de brimonidina é maior quando formulado com Purite® (Allergan)(20). Por isso, Katz sugeriu que a formulação com 0,15% de tartarato de brimonidina possui mesma eficácia em reduzir a PIO quando comparada à de 0,2%(21). Alguns autores reportaram resultados semelhantes(22). Entretanto, estudo realizado por outros autores relata que em pacientes com íris marrom escura, tartarato de brimonidina 0,2% possui maior capacidade de reduzir a PIO(23).
Seguindo o raciocínio de biodisponibilidade, foi lançado no mercado o Alphagan Z® (Allergan, Irvine, CA), o qual possui concentração da droga de 0,1%, mantendo o conservante Purite® na formulação. Quando usado duas vezes ao dia, teve mesma eficácia em reduzir a PIO comparado ao Alphagan P® (Allergan, Irvine, CA) em estudo randomizado de 12 meses(24). Entretanto, mostrou-se mais seguro quanto à reação sistêmica e toleralibilidade(25). Foi superior também à brinzolamida 1% na redução da PIO quando utilizado como terapia adjuvante ao latonoprost(26).
O objetivo do presente estudo é avaliar o efeito hipotensor de três formulações de tartarato de brimonidina em pacientes normais a curto prazo.
MÉTODOS
Estudo prospectivo, duplo cego, randomizado, o qual foi realizado pelo departamento de glaucoma da Universidade Federal do Triângulo Mineiro, sob aprovação do comitê de ética pelo número de protocolo 1495.
Os inclusos no estudo foram voluntários entre 18 e 60 anos sem patologia oftalmológica diagnosticada, sendo excluídos gestantes, menores de idade e idosos (>60 anos).
Após exames de acuidade visual, biomicroscopia e fundo de olho, os 60 voluntários foram submetidos à aferição da PIO de ambos os olhos antes da instilação do colírio. Cada colírio recebeu uma numeração que era desconhecida tanto pelo médico examinador quanto pelo voluntário. Foi assim distribuído: colírio 1 tartarato de brimonidina 0,15% (Alphagan P®; Allergan, Irvine, CA) - 40 olhos, colírio 2 tartarato de brimonidina 0,2% (Alphagan®; Allergan, Irvine, CA) - 40 olhos, e colírio 3 tartarato de brimonidina 0,1% (Alphagan Z®; Allergan, Irvine, CA) - 40 olhos. Após a instilação de uma gota de colírio em cada olho, a PIO do voluntário era aferida após 30 minutos, 1 hora e 2 horas, utilizando o mesmo tonômetro de aplanação de Goldmann. Em cada voluntário foi utilizada a mesma formulação para ambos os olhos. Os dados estatísticos descritivos foram calculados, para realizar a comparação entre os períodos de estudo dentro de cada grupo utilizamos o teste de Friedman. Também foi analisada a variação da PIO pós instilação do colírio em valores porcentuais em relação à PIO inicial. As diferenças entre os grupos foram comparadas pelo teste de Kruskal-Wallis.
Durante o tempo de avaliação da PIO os pacientes foram arguidos sobre efeitos colaterais sistêmicos e/ou locais.
RESULTADOS
A amostra analisada foi composta por 120 olhos de 60 voluntários com idade média (± desvio padrão) de 32,84 (± 10,81), sendo cada grupo composto por 40 olhos. Na tabela 1 consta as médias da pressão intraocular (PIO) com respectivos desvios padrões de cada colírio em relação ao tempo pré e pós instilação.
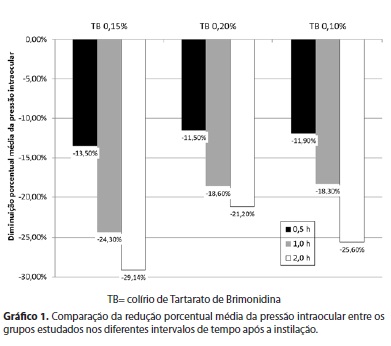
Observou-se que todas as concentrações de tartarato de brimonidina (0,2%, 0,15%, 0,1%) reduziram a PIO durante o tempo estudado de forma estatisticamente significante (p<0,001 para colírios 1, 2 e 3). Ao ser analisada a diferença porcentual do efeito hipotensor de cada grupo, verificou-se que não há diferença significativa entre os colírios estudados: (1) -13,50%, (2) -11,50%, (3) -11.90% após 30 minutos (p=0,650); (1) -24,30%, (2) -18,60%, (3) -18,30% após 1 hora (p=0,324); (1) -29,14% (2) -21,20%, (3) -25,60% após 2 hora (p=0,068), como demonstrado no gráfico 1. Não foram relatados efeitos adversos sistêmico e locais após instilação dos colírios.
DISCUSSÃO
Neste estudo randomizado e duplo cego, as três formulações do colírio de tartarato de brimonidina mostraram-se eficazes na redução da PIO em pacientes sem patologia ocular, como relatado por diversos estudos na literatura. Durante o período de acompanhamento da PIO, não houve diferença porcentual significativa entre os três colírios, portanto sendo de mesma eficácia.
Este resultado confirma achados de outros estudos que mostraram mesma capacidade de reduçao da PIO, entre estas formulações, porém sempre compararam somente duas das formulações. Katz e Mundorf chegaram a conclusão que Alphgan P® (Allergan, Irvine, CA) e Alphagan® (Allergan, Irvine, CA) têm a mesma eficácia, enquanto Cantor afirmou que Alphagan P® (Allergan, Irvine, CA) e Alphagan Z® (Allergan, Irvine, CA) também compartilham de mesma eficácia(21,22,24). O presente estudo e os outros mencionados concordam que apesar da menor concentração ativa de droga, a biodisponibilidade com o uso do conservante Purite® (Allergan) é maior, e assim proporciona mesma ação da droga.
Entretanto, Chan et al., reportaram que Alphagan® (Allergan, Irvine, CA) possui eficácia maior quando utilizado duas vezes ao dia em indivíduos com íris marrom escura quando comparado ao Alphagan P® (Allergan, Irvine, CA)(23). Já foi descrito que a pigmentação iriana pode influenciar no efeito de drogas antiglaucomatosas, pois tecidos pigmentados obtiveram maior concentração da droga, e redução mais lenta da mesma(27,28). Em seu estudo Kim et al., relata que a durabilidade da ação dos colírios nesta população é diferente, sendo maior com Alphagan® (Allergan, Irvine, CA) e que a ação de pico é semelhante entre os colírios(23).
Neste estudo analisou-se a ação dos colírios por um curto período de tempo, avaliando-se somente a ação hipotensora de pico dos mesmos, e não a durabilidade e efeito a longo prazo como os demais estudos. A população do estudo é heterogênia e randomizada, portanto não foi usado como critério de inclusão ou exclusão a coloração iriana.
Em relação a efeitos colaterais locais e sistêmicos, o tempo de estudo foi muito curto para qualquer análise. Até mesmo no período de duas horas, não se pode fazer análises por causa do uso de colírio anestésico durante as aferições da PIO. Katz e Kim concordaram quando compararam Alphagan® (Allergan, Irvine, CA) e Alphagan P® (Allergan, Irvine, CA), que com a redução da concentração ativa da droga, os efeitos colaterais oculares são menores e menos severos. Já Cantor et al., relatou que Alphagan Z® (Allergan, Irvine, CA) é mais seguro quanto à reação sistêmica e tolerabilidade quando comparado ao Alphagan P®(Allergan, Irvine, CA)(24). Sullivan-Mee et al., testaram a taxa de hipersensibilidade ao colírio genérico de tartarato de brimonidina 0,2% em pacientes usuários sem sintomas de tartarato de brimonidina Purite® 0,15% (Allergan, Irvine, CA), e obtiveram como resultado que esta taxa é similar aos de usuários originais de brimonidina 0,2%. Publicaram ainda, que quando estes pacientes retornaram ao uso de brimonidina Purite® 0,15% (Allergan, Irvine, CA) cerca de 80% obtiveram sucesso, concluindo que o conservante e que a menor concentração de droga estão implicados na hipersensibilidade aos colírios(29).
CONCLUSÃO
Este estudo foi pioneiro na comparação entre as três formulações no quesito eficácia hipotensora a curto prazo. Necessita-se de um estudo prospectivo randomizado de longa duração, que compare as três formulações quanto à eficácia hipotensora de pico e a longo prazo, bem como tolerabilidade e efeitos colaterais sistêmicos e locais.
Em suma, o presente estudo concluiu que não houve diferença estatisticamente significativa na redução da PIO no período de pico entre as três formulações de colírio de tartarato de brimonidina testadas.
REFERÊNCIAS
1. Melamed A, David R. Ongoing clinical assessment of the safety profile and efficacy of brimonidine compared with timolol: year-three results. Brimonidine Study Group II. Clin Ther. 2000;22(1):103-11.
2. Walters TR. Development and use of brimonidine in treating acute and chronic elevations of intraocular pressure: a review of safety, efficacy, dose response, and dosing studies. Surv Ophthalmol. 1996;41(Suppl. 1):S19-26.
3. Toris CB, Gleaseon ML, Camras, CB, Yablonski ME. Effects brimonidine on aqueous humor dynamics in human eyes. Arch Ophthalmol. 1995;113(12):1513-7.
4. Schuman JS, Horwitz B, Choplin NT, David R, Albracht D, Chen K. A 1-year study of brimonidine twice-daily in glaucoma and ocular hypertension: A controlled, randomized, multicenter clinical trial. The Chronic Brimonidine Study Group. Arch Ophthalmol. 1997;115(7):847-52. Comment in: Arch Ophthalmol. 1999;117(3):417-9.
5. Lee DA. Efficacy of brimonidine as replacement therapy in patients with open-angle glaucoma or ocular hypertension. Clin Ther. 2000;22(1):53-65.
6. Lee DA, Gornbein J, Abrams C. The effectiveness and safety of brimonidine as mono-, combination, or replacement therapy for patients with primary open-angle glaucoma or ocular hypertension: a post hoc analysis of an open-label community trial. The Glaucoma Trial Study Group J Ocul Pharmacol Ther. 2000;16(1):3-18.
7. Chen TC, Ang RT, Grosskreuz CL, Pasquale LR, Fan JT. Brimonidine 0.2% versus apraclonidine 0.5% for prevention of intraocular pressure elevations after anterior segment laser surgery. Ophthalmology. 2001;108(6):1033-8. Comment in: Ophthalmology. 2002; 109(5):828-9; author reply 829.
8. Seong GJ, Lee YG, Lee JH, Lim SJ, Lee SC, Hong YJ, et al. Effect of 0.2% brimonidine in preventing intraocular pressure elevation after Nd:YAG laser posterior capsulotomy. Ophthalmic Surg Lasers. 2000;31(4):308-14.
9. Schuman JS. Clinical experience with brimonidine 0.2% and timolol 0.5% in glaucoma and ocular hypertension. Surv Ophthalmol. 1996;41(Suppl. 1):S27-37.
10. Katz LJ. Brimonidine tartrate 0.2% twice-daily vs. timolol 0.5% twice-daily: 1-year results in glaucoma patients. Brimonidine Study Group. Am J Ophthalmol. 1999;127(1):20-6.
11. Serle JB. A comparison of the safety and efficacy of twice-daily brimonidine 0.2% versus betaxolol 0.25% in subjects with elevated intraocular pressure. The Brimonidine Study Group. Surv Ophthalmol. 1996;41(Suppl. 1):S39-47.
12. LeBlanc RP. Tweilve-month results of an ongoing randomized trial comparing brimonidine tartrate 0.2% and timolol 0.5% given twice daily in glaucoma or ocular hypertension. The Brimonidine Study Group. Ophthalmology. 1998;105(10):1960-7.
13. Javitt J, Goldberg I. Comparison of the clinical success rates and quality of life effects of brimonidine tartrate 0.2% and betaxolol 0.25% suspension in patients with open-angle glaucoma and ocular hypertension. Brominidine Outcomes Study Group II. J Glaucoma. 2000;9(5):398-408.
14. Berdy GJ, Abelson MB, Smith LM, George MA. Preservative-free artificial preparations. Assessment of corneal epithelial toxic effects. Arch Ophthalmol. 1992;110(4):528-32.
15. Pisella PJ, Fillacier K, Elena PP, Debbasch C, Baudouin C. Comparison of the effects of preserved and unpreserved formulations of timolol on the ocular surface of albino rabbits. Ophthalmic Res. 1992;32(1):3-8.
16. Gasset AR, Ishii Y, Kaufman HE, Miller T, Cytotoxicity of ophthalmic preservatives. Am J Ophthalmol. 1974;78(1):98-105.
17. De Saint Jean M, Debbasch C, Brignole F, Rat P, Warnet JM, Baoudouin C. Toxicity of preserved and unpreserved glaucoma topical drugs in an in vivo model of conjunctival cells. Curr Eye Res. 2000;20:85-94.
18. Grant R, Ajello M, Vlass E. Salt water or high tech? A look at two new rising solutions for contact lenses. Opician. 1996;212:38-41.
19. Masschelein WJ. Chlorine dioxide, chemistry and environmental impact of oxychlorine compounds. An Arbor, MI: Ann Arbor Science; 1979.
20. Data on file. Department of Pharmacokinetics and Drug Metabolism. Irvine: Allergan; 1999.
21. Katz LJ. Twelve-month evaluation of brimonidine-purite versus brimonidine in patients with glaucoma or ocular hypertension. J Glaucoma. 2002;11(2):119-26.
22. Mundorf T, Williams R, Whitcup S, Felix C, Batoosingh A. A 3-month comparison of efficacy ans safety of brimonidine-purite 0.15% and brimonidine 0.2% in patients with glaucoma or ocular hypertension. J Ocul Pharmacol Ther. 2003;19(1):37-44. Erratum in: J Ocul Pharmacol Ther. 2004;20(4):372.
23. Kim CY, Hong S, Seong GJ. Brimonidine 0.2% versus brimonidine Purite 0.15% in Asian ocular hypertension. J Ocul Pharmacol Ther. 2007;23(5):481-6.
24. Cantor LB, Safyan E, Liu CC, Batoosingh AL. Brimonidine-purite 0.1% versus brimonidine-purite 0.15% twice daily in glaucoma or ocular hypertension: a 12-month randomized trial. Curr Med Res Opin. 2008;24(7):2035-43.
25. Cantor LB, Liu CC, Batoosingh AL, Holland DA. Safety and tolerability of brimonidine purite 0.1% and brimonidine purite 0.15%: a meta-analysis of two phase 3 studies. Curr Med Res Opin. 2009;25(7):1615-20.
26. Day DG, Hollander DA. Brimonidine purite 0.1% versus brinzolamide 1% as adjunctive therapy to latanoprost in patients with glaucoma or ocular hypertension. Curr Med Res Opin. 2008;24(5):1435-42.
27. Acheampong AA, Shackleton M, Tang-Liu DD. Comparative ocular pharmacokinetics of brimonidine after a single dose application to the eyes of albino and pigmented rabbits. Drug Metab Dispos. 1995;23(7):708-12.
28. Acheampong AA, Shackleton M, Jonh B, Burke J, Wheeler L, Tang-Liu D. Distribution of brimonidine into anterior and posterior tissues of monkey, rabbit, and rat eyes. Drug Metab Dispos. 2002;30(4):421-9.
29. Sullivan-Mee M, Pensyl D, Alldredge B, Halverson K, Gerhardt G, Qualls C. Brimonidine hypersensitivity when switching between 0,2% and 0,15% formulations. J Ocul Pharmacol Ther. 2010;26(4):355-60.
 Endereço para correspondência:
Endereço para correspondência:
Túlio Batista Abud.
Rua Major Eustáquio, 662 - Apto. 101
Uberaba (MG) - 38010-270 - Brasil
E-mail: [email protected]
Submetido para publicação: 21 de junho de 2012
Aceito para publicação: 20 de janeiro de 2013
Financiamento: No specific financial support was available for this study
Divulgação de potenciais conflitos de interesses: T.B.Abud, Nenhum; M.Scuoteguazza Filho, Nenhum; E.S.S.Oliveira, Nenhum; J.F.Abud, Nenhum; J.A.Prata Jr., Nenhum.
Projeto CEP: 1495 - Universidade Federal do Triângulo Mineiro.
Estudo realizado no Departamento de Oftalmologia Universidade Federal do Triângulo Mineiro - Uberaba (MG).