

Simone Tiemi Yabiku1; Mariann Midori Yabiku1; Kátia Mantovani Bottós1; Aline Lutz Araújo1; Denise de Freitas2; Rubens Belfort Jr.1
DOI: 10.1590/S0004-27492011000600007
RESUMO
OBJETIVOS: Determinar a efetividade e a toxicidade do ganciclovir 0,15% gel no tratamento de ceratoconjuntivites adenovirais e na prevenção de complicações tais como infiltrados corneanos, membranas ou pseudomembranas conjuntivais. MÉTODOS: Ensaio clínico duplo-cego, intervencionista, randomizado. Os 33 pacientes com diagnóstico clínico de ceratoconjuntivite adenoviral com início dos sintomas há menos de cinco dias foram randomizados em dois grupos: Grupo 1 (tratamento) com 19 pacientes que usaram ganciclovir e Grupo 2 (controle) com 14 pacientes que usaram lágrima artificial sem conservante. Todos pacientes responderam a um questionário de sinais e sintomas e foram submetidos a um exame oftalmológico. No 6º dia de tratamento responderam ao mesmo questionário por telefone e no 10º dia foram reavaliados pelo mesmo examinador e responderam novamente ao questionário. Os sinais e sintomas foram comparados. Para análise estatística foi utilizado os testes T de Student, Mann-Whitney e Wilcoxon, com significância estatística p<0,05. RESULTADOS: Tendência de melhor resposta no grupo tratamento em relação à percepção pelos pacientes, além da melhora mais rápida desse grupo em relação ao grupo controle (p=0,26). Houve menor transmissão para o olho adelfo (p=0,86) e para pessoas do convívio (p=0,16) no grupo tratamento. Comparando os dois grupos não houve diferença estatística em relação aos sintomas e sinais da conjuntivite. Comparando isoladamente cada grupo entre o pré-tratamento e no decorrer do tratamento, observou-se melhora estatisticamente significativa da dor, prurido e fotofobia apenas no grupo tratamento. Ganciclovir não mostrou toxicidade e teve maior tolerância pelos pacientes. Não houve diferença significativa no aparecimento de complicações da conjuntivite entre os dois grupos. CONCLUSÕES: O estudo evidenciou uma tendência à melhora mais rápida dos sinais e sintomas dos pacientes tratados com ganciclovir em relação ao grupo controle, porém não estatisticamente significante. Esses resultados precisam ser confirmados por estudos adicionais, com maior número de pacientes e um seguimento mais extenso. Clinical Trails.gov: NCT01349452
Descritores: Ganciclovir; Conjuntivite viral; Infecções humanas por adenovírus; Ceratoconjuntivite; Conjuntivite; Infecções humanas por adenovírus; Adenovírus humanos; Géis; Ensaio clínico controlado aleatório; Humanos
ABSTRACT
PURPOSE: To evaluate the efficacy and the toxicity of 0.15% ganciclovir gel in the treatment of adenoviral conjunctivitis and in preventing ocular complications after adenoviral conjunctivitis, such as corneal infiltrates and pseudomembranes. METHODS: Double blind, interventional and randomized clinical trial. Thirty-three patients with clinical diagnosis of adenoviral conjunctivitis with onset of symptoms for five or less days were randomized in two groups: Group 1 (treatment) with 19 patients used ganciclovir gel and Group 2 (control) with 14 patients used artificial tears without preservative. Patients answered a questionnaire of signs and symptoms and were submitted to an ophthalmologic exam. On the 6th and 10th days of treatment they answered the same questions and were re-examined by the same ophthalmologist. Signs and symptoms were compared. T Student, Mann-Whitney e Wilcoxon tests were used to statistical analysis. RESULTS: Trend of better response in the treatment group in relation of patients' perception, besides faster improvement of this group compared to the control group (p=0.26). There were lower transmission to the fellow eye (p=0.86) and to people living together (p=0.16) in the treatment group. No statistical difference related to signs and symptoms of conjunctivitis were found comparing both groups. We observed statistical difference in pain, itch and photophobia only in the treatment group, comparing each group alone. No toxicity and more tolerance of the ganciclovir were observed. There was no statistical difference in the ocular complications after conjunctivitis between both groups. CONCLUSIONS: This study showed trend of better and faster response of the signs and symptoms of the patients treated with ganciclovir compared with the control group, but with no statistical significant. These results need to be confirmed by additional studies, with more patients and longer follow-up. Clinical Trails.gov: NCT01349452
Keywords: Ganciclovir; Conjunctivitis; Adenovirus infections; Keratoconjunctivitis; Conjunctivitis; Adenovirus infections, human; Adenoviruses, human; Gels; Randomized controlled trial; Humans
INTRODUÇÃO
A infecção ocular adenoviral é um processo infeccioso autolimitado, altamente contagioso e muito frequente, podendo ocorrer em surtos epidêmicos(1-3). Pode se apresentar de três formas clínicas agudas: conjuntivite folicular aguda inespecífica, febre faringo-conjuntival e ceratoconjuntivite epidêmica(4,5). O paciente tem queixas de ardência, dor, fotofobia, prurido, irritação e lacrimejamento(1-3). Na fase aguda da doença, observa-se em intensidades variáveis folículos na conjuntiva tarsal, secreção serosa ou mucosa, edema palpebral, quemose, ceratite punctata, adenopatia pré-auricular e, na fase mais tardia, infiltrados subepiteliais na córnea(1). O quadro pode variar desde uma inflamação leve com hiperemia conjuntival difusa e reação folicular e papilar até uma inflamação grave com hemorragia subconjuntival, pseudomembranas ou membranas tarsais(1-4). O início é agudo, com sintomas após 6 a 9 dias da exposição. O quadro ocular é geralmente bilateral, ocorrendo simultaneamente ou com uma diferença de três dias entre os dois olhos e em geral, no segundo olho o quadro é mais leve(4,5).
O diagnóstico da conjuntivite adenoviral é geralmente clínico, baseado nos sinais e sintomas, e epidemiológico(1,6). A identificação do vírus não é usualmente possível e o tratamento não depende dessa identificação. O padrão ouro para diagnóstico é o isolamento através da cultura do vírus, mas é demorado, caro e necessita do vírus ainda infectante. Técnicas de detecção de antígenos requerem menos tempo e não necessitam de organismos viáveis. Testes de diagnósitco rápido para detecção de adenovírus, como o RPS Adenodetector, tem sensibilidade de 100% e pode ser importante no controle da disseminação da infecção(5,7).
O tratamento da conjuntivite adenoviral é sintomático, não havendo terapia específica e inclui a prevenção da transmissão e das complicações. Os pacientes são orientados a evitar contato próximo com outras pessoas, não cumprimentar com as mãos, lavar as mãos sempre que tocar os olhos ou pessoas, usar desinfetantes periodicamente e não compartilhar toalhas e travesseiros. Compressas frias, lágrimas artificiais e óculos de sol ajudam no alívio dos sintomas. O uso de corticosteróides é controverso e deve ser prescrito com cautela, considerando seus riscos e benefícios. Anti-inflamatórios não esteroidais tópicos não são eficazes na conjuntivite viral e a eficácia dos anti-inflamatórios orais não está bem estabelecida(8).
Várias drogas foram testadas para o tratamento da conjuntivite viral, como a ciclosporina, trifluridina, iodopovidona, cidofovir, porém nenhuma delas provou ser eficaz(9). Não há tratamento específico nem profilático para evitar o contágio interhumanos ou a transmissão para o segundo olho do paciente. Alguns agentes como o ganciclovir tem mostrado benefícios potenciais para esta condição(10-14) e por esta razão foi realizado este estudo. O ganciclovir tópico já é comercializado em vários países da Europa, Ásia, África e América do Sul para tratamento de herpes ocular.
OBJETIVO
Determinar a efetividade e a toxicidade do ganciclovir 0,15% gel no tratamento de ceratoconjuntivites adenovirais e na prevenção de complicações, tais como infiltrados corneanos e membranas ou pseudomembranas conjuntivais.
MÉTODOS
O ensaio clínico duplo-cego, intervencionista, randomizado foi realizado no Departamento de Oftalmologia da Universidade Federal de São Paulo (Unifesp) no período de agosto de 2009 a janeiro de 2010. O protocolo foi aceito pelo Comitê de Ética e Pesquisa da Unifesp.
Foram incluídos no estudo pacientes com diagnóstico clínico de ceratoconjuntivite adenoviral com início dos sintomas há cinco dias ou menos que procuraram atendimento no pronto-socorro de oftalmologia do Hospital São Paulo, da Unifesp. Esses pacientes foram distribuídos, de forma randomizada, em dois grupos:
Grupo 1 - grupo tratamento: 19 pacientes que receberam ganciclovir 0,15% gel para ser aplicado 4 vezes ao dia em ambos os olhos.
O ganciclovir e a lágrima artificial sem conservante foram manipulados e cedidos para este estudo, sob solicitação e iniciativa dos autores, pela Ophthalmos Indústria Farmacêutica de São Paulo. Nenhum dos autores tem qualquer interesse financeiro ou comercial no produto.
Os critérios de inclusão foram: início dos sintomas há cinco dias ou menos; ser maior de 18 anos; não estar grávida ou amamentando e ser capaz (legal e mentalmente) de entender e assinar o termo de consentimento informado livre e esclarecido.
Os critérios de exclusão foram: uso de corticosteróide ou antibiótico por quaisquer vias nos 30 dias antes da inclusão no estudo; doenças sistêmicas que, na opinião do investigador, pudessem colocar o paciente em risco; paciente com visão em apenas um olho ou presença de outras ceratopatias e/ou doenças oculares.
Os pacientes responderam a um questionário sobre sinais e sintomas e foram submetidos ao exame oftalmológico. Foram questionados em relação a ardência, dor, prurido, fotofobia, lacrimejamento, secreção e desconforto ocular ou sensação de areia nos olhos. Cada um dos itens foi classificado pelo paciente como ausente, leve, moderado ou intenso. No exame oftalmológico foram avaliados acuidade visual com a correção utilizada pelo paciente, presença de adenopatia cervical e pré-auricular, quemose, hiposfagma, petéquias conjuntivais, infiltrados corneanos subepiteliais, ceratite puntacta, membranas e pseudomembranas. Edema palpebral e hiperemia conjuntival foram classificados em ausente, leve, moderado e grave. A reação folicular conjuntival foi quantificada em graus I, II e III. Ao término da consulta todos pacientes receberam um frasco com medicação ou placebo para usar em ambos os olhos durante 10 dias.
Após seis dias, o mesmo questionário da primeira consulta foi aplicado por telefone. O paciente foi questionado sobre o uso correto da medicação e se sentiu algum incômodo após a instilação da medicação. O paciente respondeu se obteve melhora dos sintomas (nenhuma, pouca, razoável ou muita melhora) e após quantos dias percebeu essa melhora, se alguém do convívio adquiriu conjuntivite e se os sintomas passaram para o olho contralateral.
Os pacientes foram reavaliados pelo mesmo examinador no 10º dia de tratamento. O mesmo questionário da primeira consulta e do dia 6 foi reaplicado. O exame oftalmológico avaliou os mesmos parâmetros do dia inicial. Os parâmetros para avaliação da tolerância do medicamento foram: borramento visual, ardência ou sensação de queimação após a aplicação.
Ao final das duas consultas e do contato telefônico, os sinais e sintomas dos pacientes que completaram o tratamento corretamente foram comparados. Os quesitos avaliados foram: uso adequado da medicação; quantificação subjetiva pelo paciente da melhora da conjuntivite (muita, razoável, pouca ou nenhuma) e de cada um dos seus sintomas individualmente (ardência, dor, prurido, fotofobia, lacrimejamento, secreção, sensação de areia); em quantos dias o paciente observou melhora dos sintomas; se houve transmissão da conjuntivite; alteração da acuidade visual e dos sinais avaliados no primeiro atendimento (edema palpebral, hiposfagma, quemose, petéquias conjuntivais, folículos, hiperemia conjuntival, infiltrado subepitelial, ceratite punctata, opacidade subepitelial, pseudomembrana ou membrana e adenopatia pré-auricular ou submandibular).
Para os cálculos estatísticos, foram incluídos os dados de apenas um olho por paciente: se a conjuntivite era unilateral, considerou-se o olho acometido na primeira avaliação; se a conjuntivite era bilateral, convencionou-se a inclusão do olho direito. A análise estatística foi realizada com o programa SPSS, versão 13.0. Para comparações entre os grupos 1 e 2, utilizou-se o teste T de Student para a variável idade e o teste de Mann-Whitney para as demais variáveis. Para comparações dentro do mesmo grupo entre as variáveis no pré-tratamento, aos 6 e aos 10 dias de tratamento, empregou-se o teste de Wilcoxon. Foi definida significância estatística p<0,05.
RESULTADOS
Quarenta e seis pacientes com conjuntivite adenoviral conforme critério de inclusão foram inicialmente randomizados para a participação no estudo; destes, 33 responderam à avaliação ao sexto dia de tratamento e 27 compareceram à consulta ao décimo dia de tratamento.
Dentre os 33 pacientes incluídos na análise, 19 (57,57%) pertenciam ao grupo tratamento e 14 (42,42%) ao grupo controle. As características demográficas, sinais e sintomas dos pacientes de cada grupo antes de iniciar o tratamento são apresentados na tabela 1. Não houve diferença estatística entre os grupos em todas as variáveis consideradas antes do tratamento.
Comparando-se os grupos tratamento e controle, não se encontrou diferença significativa dos sinais e sintomas da conjuntivite ao longo do tratamento. Considerando-se cada grupo separadamente, observou-se melhora de dor, prurido e fotofobia apenas no grupo tratamento (aos 6 dias de tratamento, p<0,01, p<0,01 e p=0,01, respectivamente; aos 10 dias de tratamento, p=0,05, p<0,01 e p=0,01). Aos 10 dias de tratamento, a graduação de secreção referida pelos pacientes foi significativamente menor apenas no grupo controle (p<0,01; no grupo tratamento, p=0,06). Os resultados dos sinais e sintomas de cada grupo ao longo do tratamento estão apresentados na tabela 2.
A percepção pelos pacientes de melhora dos sintomas ao longo do tratamento é apresentada na figura 1. Observa-se tendência de melhor resposta no grupo tratamento, mas a diferença não foi estaticamente significativa aos 6 (p=0,27) ou 10 dias (p=0,16). Entre os pacientes que relataram melhora dos sintomas, o tempo após iniciar o tratamento para notar melhora foi de 2,9 ± 1,4 dias no grupo tratamento e 3,2 ± 1,3 dias no grupo controle (p=0,26).
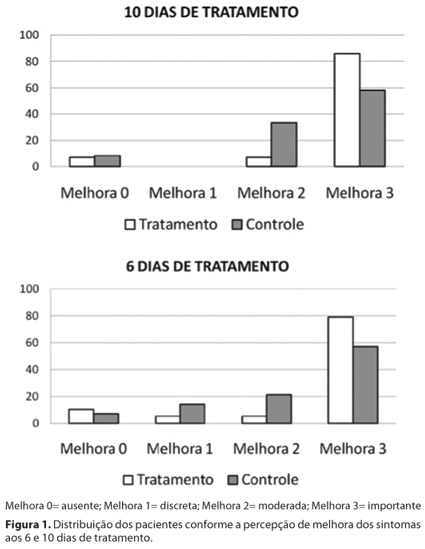
A transmissão da conjuntivite para o olho adelfo havia ocorrido em 33,3% dos pacientes do grupo tratamento e em 37,5% dos pacientes do grupo controle aos 6 dias de tratamento (p=0,86), e em 14,3% e 20%, respectivamente, aos 10 dias (p=0,80). O relato de aparecimento de conjuntivite em pessoas do convívio esteve presente em 5,3% do grupo tratamento e em 14,3% do grupo controle aos 6 dias (p=0,38) e, desta avaliação para a seguinte, mais 16,7% dos pacientes do grupo controle referiram transmissão a pessoas do convívio, ao passo que nenhum caso novo no grupo tratamento foi relatado no mesmo período (p=0,11). Não houve diferença estatística na transmissão da conjuntivite entre os grupos ao longo do tratamento.
Em relação à tolerância ao medicamento, a instilação de ganciclovir causou ardência em 47,4% e borramento visual 15,8%, e o placebo gerou os mesmos sintomas em 61,5% e 30,8%, respectivamente. O relato de qualquer desconforto após a instilação ocorreu em 63,2% do grupo tratamento e em 92,3% do grupo controle (p=0,06).
DISCUSSÃO
Ganciclovir é um antiviral mais seletivo e menos tóxico, em comparação a outros antivirais mais antigos(15). Ganciclovir e aciclovir possuem mecanismos farmacológicos similares: timidinas quinases convertem ganciclovir e aciclovir em um derivado ativo de trifosfato, principalmente nas células infectadas. Uma vez fosforilados, ganciclovir inibe a síntese de DNA viral de duas formas: inibição competitiva da DNA-polimerase viral e incorporação direta dentro do primer viral de DNA, que resulta na terminação da cadeia do DNA viral e previne a replicação viral(15,16). O ganciclovir, um nucleosídeo sintético análogo da deoxiguanosina-2, mostrou ser um potente inibidor de replicação viral para HSV1, HSV2, HZV, EBV, CMV, HHV6, vírus da hepatite B e em algumas amostras de adenovírus (17-20).
Ganciclovir 0,15% gel oftálmico é comercializado desde 1996 como Virgan®, pelo Laboratoires Théa, em mais de 30 países dentro da Europa, Ásia, África e América do Sul. Em 2007, o US Food and Drug Administration (FDA) aprovou a droga para o tratamento da ceratite herpética aguda (Zirgan®, Sirion Therapeutics)(15). O ganciclovir gel parece oferecer melhor perfil de segurança com eficácia similar ou melhor e menos toxicidade que a trifluridina 1%, segundo Herbert E. Kaufman, MD. A fórmula do ganciclovir foi desenvolvida na Europa para uso oftalmológico seguindo os seguintes critérios: boa tolerância, viscosidade para assegurar um período prolongado de retenção, tonicidade similar à lágrima, ph fisiológico (7,45), autoclavável, tempo de vida longo e estável, proteção antimicrobiana conforme regulação européia, forma de gel aquoso que permite distribuição homogênea e tempo prolongado de contato com a superfície corneana(15).
Muitos estudos foram realizados para avaliar a eficácia do ganciclovir no tratamento da ceratite herpética. Ensaios clínicos demonstraram bons resultados comparados com o tratamento padrão com aciclovir. O ganciclovir mostrou ser um antiviral tópico seguro e eficaz, com menos toxicidade e posologia mais conveniente(15,21-23). No entanto não existem estudos registrados no ClinicalTrials.gov em relação ao uso do ganciclovir em ceratoconjuntivite adenoviral. A literatura mostra apenas um estudo apresentado em forma de pôster no encontro da Association for Research in vision and Ophthalmology (ARVO) de 2001, onde foram comparados os efeitos do ganciclovir gel oftálmico 0,15% com a lágrima artificial sem conservante em 18 pacientes com ceratoconjuntivite adenoviral. O grupo tratado com ganciclovir teve um tempo de recuperação menor em relação ao grupo que usou lágrima artificial (7,7 dias versus 18,5 dias, com p<0,05). Os autores concluíram que ganciclovir gel 0,15% foi superior na resolução da infecção e no alívio dos sintomas. A droga mostrou ser segura e efetiva no tratamento da ceratoconjuntivite adenoviral e seu uso precoce poderia prevenir ou alterar a gravidade das opacidades subepiteliais, reduzindo sequelas e morbidade ocular(11). Os efeitos adversos associados ao uso do ganciclovir gel foram: visão borrada transitória (60%), irritação ocular (20%), ceratite puntacta (5%) e hiperemia conjuntival (5%), porém essas reações poderiam estar mais relacionadas com a infecção do que com a droga. Apesar da pequena amostra, esse estudo mostrou resultados promissores do ganciclovir gel 0,15% como um tratamento seguro e efetivo para ceratoconjuntivite adenoviral(11).
Apesar de existirem muitos estudos com o intuito de encontrar uma droga efetiva contra a ceratoconjuntivite adenoviral, nenhum deles foi conclusivo. Devido à necessidade de se obter um tratamento eficaz para essa condição, que é comum e altamente contagiosa, o presente ensaio clínico foi realizado. Ganciclovir pode ser um possível tratamento, visto que é ativo contra adenoviroses, porém em concentrações maiores que as usadas para inibir herpes vírus, ao contrário do aciclovir que é inativo(11-13,15).
No atual estudo, observou-se melhora estatisticamente significativa de sintomas como dor, prurido e fotofobia comparando o pré-tratamento com o 6º dia e com o 10º dia de tratamento apenas no grupo tratamento. Nesse grupo tratamento, observou-se melhora mais rápida em relação ao grupo controle, porém essa diferença não foi estatisticamente significativa. Houve uma tendência de melhor resposta no grupo tratamento em relação à percepção pelos pacientes da melhora dos sintomas ao longo do tratamento, com uma maior porcentagem dos pacientes desse grupo referindo muita melhora dos sintomas. Apesar dos melhores resultados em relação aos sintomas, sinais e tempo de melhora no grupo tratamento, muitos desses parâmetros não mostrou diferença significativa.
A droga em estudo não mostrou toxicidade. Em relação à tolerância ao medicamento, 63,2% dos pacientes do grupo tratamento e 92,3% dos pacientes do grupo controle referiram algum sintoma após a instilação do mesmo. Ardência e borramento visual logo após o uso do colírio também foram citados no estudo de alguns autores(11) e podem estar relacionados com a infecção e não necessariamente com a medicação. O grande número de pacientes que tem algum sintoma ao instilar lágrima artificial justifica o fato de muitos oftalmologistas preferirem não prescrever o colírio como sintomático na conjuntivite adenoviral. Foi observada maior tolerância ao uso do ganciclovir em relação à lágrima artificial, apesar dessa diferença não ser estatisticamente significativa.
Nesse estudo, não houve diferença significativa no aparecimento de complicações como infiltrados, membranas e pseudomembranas entre os dois grupos. A taxa de transmissão ao olho adelfo ou a pessoas do convívio também não mostrou diferença entre os grupos. Alguns fatores que podem ter influenciado nos resultados obtidos são a amostra pequena de pacientes e o tempo de seguimento dos mesmos. Uma grande dificuldade encontrada foi conseguir o retorno dos pacientes às consultas de "follow up" do estudo.
A ceratoconjuntivite viral é um importante problema de saúde pública por ser uma doença frequente e altamente contagiosa, levando facilmente a surtos epidêmicos. O custo de um cidadão com essa doença é muito alto, incluindo gastos médicos com o diagnóstico e tratamento, com medidas preventivas e gastos com o afastamento do paciente de suas atividades laborativas devido à necessidade de isolamento pela transmissibilidade da doença(24,25).
Alguns estudos na literatura mostram os elevados gastos diretamente associados ao surto de conjuntivite adenoviral, concluindo que medidas de prevenção são simples e com boa relação custo-benefício para a sociedade(24,25). Além da necessidade de estudar drogas efetivas para tratar a conjuntivite adenoviral para promover alívio mais rápido dos sintomas e diminuir sequelas e morbidade visual, também é importante no intuito de diminuir os altos gastos com esse grande problema de saúde pública. O presente estudo evidenciou uma tendência a melhora mais rápida dos sinais e sintomas dos pacientes tratados com ganciclovir 0,15% gel em relação ao grupo controle, porém não estatisticamente significante. Esses resultados precisam ser confirmados por estudos adicionais, com maior número de pacientes e um seguimento mais extenso.
AGRADECIMENTOS
Ophthalmos Indústria e Comércio de Produtos Farmacêuticos, na pessoa do Professor Acácio Lima Filho; Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
REFERÊNCIAS
1. Wilhelmus KR, Huang AJ, Hwang DG, Parrish CM, Sutphin JE, Whitsett JC. Clinical aspects of infectious diseases of the eyelids, conjunctiva, cornea and sclera. In: Basic and clinical Science Course. Section 8. San Francisco: American Academy of Ophthalmology. San Francisco: LEO; 1999-2000. p.134-80.
2. Montessori V, Scharf S, Holland S, Werker DH, Roberts FJ, Bryce E. Epidemic keratoconjunctivitis outbreak at a tertiary referral eye care clinic. Am J Infect Control. 1998;26(4): 399-405.
3. Tanaka K, Itoh N, Saitoh-Inagawa W, Uchio E, Takeuchi S, Aoki K, et al. Genetic characterization of adenovirus strains isolated from patients with acute conjunctivitis in the city of Sao Paulo, Brazil. J Med Virol. 2000;61(1):143-9.
4. Belfort Jr R, Kara-José N. Córnea clínica e cirúrgica. São Paulo: Contexto; 1999.
5. Krachmer JH, Mannis MJ, Holland EJ. Conjunctivitis. In: Krachmer JH, Mannis MJ, Holland EJ, editors. Cornea. 2nd ed. Vol. I. Fundamentals, diagnosis and management. Philadelphia: Elsevier Mosby; 2005. p.629-32.
6. Shiuey Y, Ambati BK, Adamis AP. A randomized double-masked trial of topical ketorolac versus artificial tears for treatment of viral conjunctivitis. Ophthalmology. 2000;107(8): 1512-7.
7. Barbosa Jr. JB, Regatieri CV, Paiva TM, Benega MA, Ishida MA, Corrêa KO, et al. Diagnóstico de conjuntivite adenoviral pelo RPS Adenodetector. Arq Bras Oftalmol. 2007;70(3):441-4.
8. Uchio E, Takeuchi S, Itoh N, Matsuura N, Ohno S, Aoki K. Clinical and epidemiological features of acute follicular conjunctivitis with special reference to that caused by herpes simplex virus type 1. Br J Ophthalmol. 2000;84(9):968-72.
9. Inoue H, Sonoda KH, Ishikawa M, Kadonosono K, Uchio E. Clinical evaluation of local ocular toxicity in candidate anti-adenoviral agents in vivo. Ophthalmologica. 2009;223(4): 233-38.
10. Naesens L, Lenaerts L, Andrei G, Snoeck R, Van Beers D, Holy A, et al. Antiadenovirus activities of several classes of nucleoside and nucleotide analogues. Antimicrob Agents Chemother. 2005;49(3):1010-6.
11. Tabbara KF. Ganciclovir effects in adenovirus keratoconjuntivitis. Poster session presented at: ARVO: Annual Association for Research in Vision and Ophthalmology; 2001 April 29-May 4; Fort Lauderdale; Florida.
12. Duggan JM, Farrehi J, Duderstadt S, Turner NJ, Fekety R. Treatment with ganciclovir of adenovirus pneumonia in a cardiac transplant patient. Am J Med. 1997;103(5):439-40.
13. Bruno B, Gooley T, Hackman RC, Davis C, Corey L, Boeckh M. Adenovirus infection in hematopoietic stem cell transplantation: effect of ganciclovir and impact on survival. Biol Blood Marrow Transplant. 2003;9(5):341-52.
14. Kinchington PR, Romanowski EG, Jerold Gordon Y. Prospects for adenovirus antivirals. J Antimicrob Chemother. 2005;55(4):424-9.
15. Colin J. Ganciclovir ophthalmic gel, 0.15%: a valuable tool for treating ocular herpes. Clin Ophthalmology. 2007;1(4):441-53.
16. Markham A, Faulds D. Gancyclovir. An update of its therapeutic use in cytomegalovirus infection. Drugs. 1994;48(3):455-84.
17. Shiota H, Naito T, Mimura Y. Anti-herpes simplex virus (HSV) effect of 9-(1,3-dihydroxy-2-propoxymethyl) guanine (DHPG) in rabbit cornea. Curr Eye Res. 1987;6(1):241-5.
18. Trousdale MD, Nesburn AB, Willey DE, Taaid H. Efficacy of BW759 (9-[[2-hydroxy-1(hydroxymethyl)ethoxy]methyl]guanine) against herpes simplex virus type 1 keratitis in rabbits. Curr Eye Res. 1984;3(8):1007-15.
19. Locarnini S, Guo K, Lucas R, Gust I. Inhibition of HBV DNA replication by ganciclovir in patients with AIDS. Lancet. 1989;2(8673):1225-6.
20. Taylor DL, Jeffries DJ, Taylor-Robinson D. The susceptibility of adenovirus infection to the anti-cytomegalovirus drug, ganciclovir. FEMS Microbiol Lett. 1988;49:337-41.
21. Hoh HB, Hurley C, Claoue C, Viswalingham M, Easty DL, Goldschmidt P, et al. Randomised trial of ganciclovir and acyclovir in the treatment of herpes simplex dendritic keratitis: a multicentre study. Br J Ophthalmol. 1996;80(2):140-3.
22. Colin J, Hoh HB, Easty DL, Herbort CP, Resnikoff S, Rigal D, et al. Ganciclovir ophthalmic gel (Virgan; 0,15%) in the treatment of herpes simplex keratitis. Cornea. 1997;16(4):393-9.
23. Tabbara KF. Treatment of herpetic keratitis. Ophthalmology. 2005;112(9):1640.
24. Piednoir E, Bureau-Chalot F, Merle C, Gotzamanis A, Wuiboult J, Bajolet O. Direct costs associated with a nosocomial outbreak of adenoviral conjunctivitis infection in a long-term care institution. Am J Infect Control. 2002;30(7):407-10.
25. Nyamogoba H, Obala AA. Nosocomial infections in developing countries: cost effective control and prevention. East Afr Med J. 2002;79(8):435-41.
Correspondence address:
Simone Tiemi Yabiku
Rua Estácio de Sá, 476
Maringá (PR) - 87010-360 - Brazil
E-mail: [email protected]
Submitted for publication: May 31, 2011
Accepted for publication: October 25, 2011
Study carried out at the Departamento de Oftalmologia da Universidade Federal de São Paulo - UNIFESP - São Paulo (SP), Brazil.
Funding: No specific financial support was available for this study.
Disclosure of potential conflicts of interest: S.T.Yabiku, None; M.M.Yabiku, None; K.M.Bottós, None; A.L.Araújo, None; D.de Freitas, None; R.Belfort Jr., None.
Comitê de Ética em Pesquisa da UNIFESP/EPM - CEP 2042/08