

Eduardo Dib1; Eduardo Büchelle Rodrigues1; Maurício Maia1; Carsten H. Meyer2; Fernando Marcondes Penha1; Bruno de Albuquerque Furlani1; Elaine de Paula Fiod Costa3; Michel Eid Farah1
DOI: 10.1590/S0004-27492009000600022
RESUMO
O objetivo do artigo é apresentar os dados atuais da aplicação de corantes vitais durante cirurgia vitreorretiniana, "cromovitrectomia", bem como uma revisão da literatura atual sobre o assunto no tocante às técnicas de aplicação, indicações e complicações em cromovitrectomia. Um grande número de publicações tem abordado o perfil tóxico da indocianina verde na cromovitrectomia. Dados experimentais mostram uma toxicidade dose-dependente da mesma em várias populações de células retinianas. Novas gerações de corantes incluem: azul tripan, azul patente, acetato de triancinolona, infracianina verde, fluoresceína sódica, azul de bromofenol, acetato de fluorometolona e azul brilhante. Novos instrumentos podem permitir um corar seletivo de estruturas durante a vitrectomia. Este artigo mostra que o campo da cromovitrectomia está em plena expansão de pesquisas. Os corantes de primeira linha são a indocianina verde, infracianina verde e o azul brilhante. Azul patente, azul de bromofenol e azul tripan surgem como novos adjuvantes para melhor observação da membrana epirretiniana. Demais corantes que surgiram merecem maior investigação.
Descritores: Vitrectomia; Corpo vítreo; Verde de indocianina; Buraco macular; Retina; Azul tripano; Agentes corantes; Membrana epirretiniana
ABSTRACT
The aim of this article is to present the current data with regard to the application of vital dyes during vitreoretinal surgery, "chromovitrectomy", as well as to overview the current literature regarding the properties of dyes, techniques of application, indications and complications in chromovitrectomy. A large body of published research has recently addressed the toxicity profile of indocyanine green for chromovitrectomy. Experimental data demonstrate dose-dependent toxicity of indocyanine green to various retinal cells. Newer generation vital dyes for chromovitrectomy include trypan blue, patent blue, triamcinolone acetonide, infracyanine green, sodium fluorescein, bromophenol blue, fluorometholone acetate and brilliant blue. Novel instruments may enable a selective painting of preretinal tissues during chromovitrectomy. This review suggests that the field of chromovitrectomy represents an expanding area of research. The first line agents for internal limiting membrane staining in chromovitrectomy are indocyanine green, infracyanine green, and brilliant blue. Patent blue, bromophenol blue and trypan blue arose as outstanding biostains for visualization of epiretinal membranes. Novel dyes available for chromovitrectomy deserve further investigation.
Keywords: Vitrectomy; Vitreous body; Indocyanine green; Macular hole; Retina; Trypan blue; Coloring agents; Epiretinal membrane
INTRODUÇÃO
Cromovitrectomia tem como significado o uso de qualquer corante vital durante cirurgia vitreorretiniana para que se possa visibilizar membranas e estruturas. Este termo foi introduzido em 2000, quando se descreveu que a indocianina verde (ICG) se mostrou capaz de corar a membrana limitante interna. Dados clínicos e experimentais, porém, mostraram um potencial de toxicidade retiniana(1) que estimulou o aumento de pesquisa neste campo. Vários novos corantes fazem parte do atual arsenal para cromovitrectomia (Tabela 1)(2). Este artigo mostrará as últimas discussões em cromovitrectomia com ênfase nas propriedades, indicações e toxicologia de cada corante disponível. Um resumo se encontra na tabela 1.
Indocianina verde (ICG)
Comercialmente disponível com os nomes: ICG-Pulsion (Pulsion Medical Systems, Munique, Alemanha; 25 mg e 50 mg); ICV Indocianina Verde (Ophthalmos, São Paulo; 10, 25 e 50 mg); Diagnogreen (Daiichi Pharmaceutical, Tóquio, Japão; 25 mgl); e IC-Green (Akorn Inc, Buffalo Grove, Illinois, EUA; 25 mg). A ICG representa o corante mais apropriado para mostrar vasculatura coroidal em exames de contraste. A ICG mostra grande afinidade aos componentes da matriz extracelular da membrana limitante interna (MLI) facilitando sua remoção(3). Cromovitrectomia com ICG ganhou aceitação mundial quando mostrou tornar a cirurgia de buraco macular bem mais facilitada(4). Também permite melhor visibilidade do tecido glial das membranas epirretinianas em vitrectomia para vitreoretinopatia diabética proliferativa e por proliferação vitreorretiniana. A ICG, no entanto, cora melhor a MLI. Outros corantes mostram melhor contraste para a cirurgia de retirada da membrana epirretiniana (MER)(5) (Figura 1).
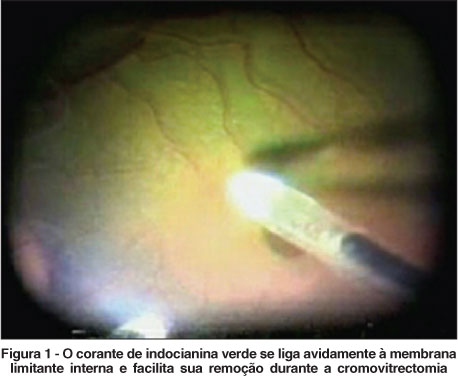
Recentemente publicações controversas apontaram possíveis efeitos tóxicos causados pela ICG(6-10). Clinicamente, as cirurgias que fizeram uso de ICG apresentaram atrofia óptica e de epitélio pigmentário da retina (EPR) bem como defeitos de campo visual(1). Análises histopatológicas disponíveis na literatura de MLI retirada durante a cromovitrectomia com ICG mostrou resultados controversos de toxicidade nos tecidos subjacentes à membrana limitante interna removida(11). A presença de constituintes retinianos como membranas plasmáticas de células de Müller, miofibroblastos e astrócitos aderidos à face retiniana da MLI após ser corada com ICG gerou um conceito de risco aumentado para lesões retinianas. Estudos in vitro e in vivo mostraram uma toxicidade dose dependente a várias células da retina incluindo EPR, fotorreceptores e células ganglionares(12). Mais pesquisas são necessárias para descobrir o mecanismo de toxicidade, bem como a razão para a grande afinidade da ICG pela MLI. Injeção sub-retiniana de ICG em coelhos resultou em dano ao EPR mesmo em concentrações menores que 0,5 mg/mL(13).
Até o momento, somente alguns estudos clínicos controlados foram realizados para comparar remoção de membranas pré-retinianas com ou sem o uso da ICG. Alguns autores(14) analisaram a remoção de MLI com e sem o uso da ICG no tratamento do buraco macular idiopático e perceberam acuidades visuais piores nos pacientes submetidos a cirurgia com o uso da ICG. Estes achados também foram encontrados por outros autores(15) tendo estes últimos relatado atrofia de nervo óptico como uma das possíveis complicações. Em contraste com estes resultados negativos, um estudo prospectivo randomizado recente(16) não mostrou diferença na acuidade visual final, risco de recidiva ou edema macular entre as cirurgias de retirada de MLI que usaram ICG versus as que não usaram. Outros autores compararam pacientes com e sem o uso de ICG na cirurgia de retirada de MLI e não reportaram efeitos adversos do corante(16-17). Os melhores resultados destes artigos podem ter sido devido ao uso de técnicas de injeção de corantes com mais critério e cuidado que as publicações anteriores. Recentemente uma meta-análise incluindo 837 olhos mostrou alterações anatômicas similares porém aspectos funcionais finais piores no grupo que usou ICG para cirurgia de buraco macular, porém, a maioria dos estudos usou ICG em altas concentrações.
Algumas considerações têm sido feitas para o uso de ICG na cirurgia de buraco macular:
1. Reduzir ao máximo o tempo cirúrgico, com o fim de diminuir o tempo de contato da ICG com células da retina (especialmente células do EPR), bem como para minimizar a exposição da ICG à luz do endoiluminador.
2. Utilizar uma concentração de ICG inferior a 0,5 mg/ml para minimizar os riscos de dano ao EPR, bem como possíveis danos à retina. A primeira diluição deve ser realizada com 0,1 ml de água destilada e a segunda diluição com uma quantidade de solução salina balanceada (BSS) necessária para alcançar uma concentração inferior a 0,5 mg/ml e osmolaridade em torno de 270 - 290 mOsm.
3. Evitar a injeção direta de ICG através do buraco macular através de um método de controle de coloração (injeção lenta, VINCE, perfluorocarbono no buraco macular).
Infracianina verde
Infracianine verde (IfCG) é um corante verde com a mesma fórmula química e propriedades farmacológicas semelhantes da ICG. IfCG também se liga com alta afinidade à MLI acelular e facilita a sua visualização semelhante ao ICG. IfCG está comercialmente disponível sob o nome Infracyanine (Laboratoires SERB, Paris, França; 25 mg). Vários ensaios experimentais e investigações clínicas(17) renderam resultados positivos com a aplicação IfCG com pouca ou nenhuma toxicidade à retina. Na pesquisa clínica o uso da IfCG para a cirurgia de buraco macular demonstrou taxas de fechamento do mesmo acima de 90%. No nosso laboratório a injeção sub-retiniana de IfCG 0,5% promoveu menos lesões retinianas tóxicas que a ICG em concentrações menores que 0,5 mg/ml(13).
IfCG possui duas diferenças quando comparada a ICG: não possui iodo em sua solução enquanto a ICG pode ter até 5% na solução final(18). Doses mais elevadas tópicas ou intraoculares de iodo mostraram-se extremamente tóxicas para a retina e a córnea. Uma segunda diferença é que, devido à presença de iodeto de sódio na ICG, esta deve ser diluída em água destilada, gerando uma solução hipotônica (248 - 275 mmol/kg) enquanto a IfCG deve ser diluída em glicose 5% gerando uma solução isotônica (294 - 314 mmol/kg) mostrando uma menor toxicidade adicional. Em resumo, a IfCG se mostra como uma importante alternativa à ICG para retirada de MLI.
Azul tripan
Este corante vital parece atravessar membranas celulares apenas em células mortas tornando-as azuis. Células vivas não são coradas devido aos seus controles de transporte transmembrana que não permitem a ligação do azul tripan (TB). O TB é utilizado de rotina em microscopia para corar sistema reticuloendotelial e túbulos renais. O uso oftalmológico iniciou nos anos 90 quando foi utilizado para corar a cápsula anterior do cristalino facilitando a capsulorrexis na cirurgia de catarata. Logo depois seu uso foi proposto para corar MLI e MER em cromovitrectomia(19). O TB pode não corar tão bem a MLI como a ICG, porém seu uso se mostra mais eficiente na cirurgia de retirada de MER minimizando o trauma à retina durante a cirurgia por permitir a visibilidade de toda a extensão da MER (Figura 2).
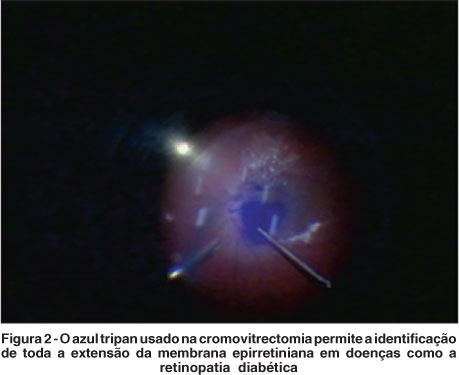
Estudos clínicos consecutivos(2) revelaram que o TB exerce pouco ou nenhum efeito tóxico à retina(20). Pesquisas experimentais, no entanto, mostraram resultados contrários. Alguns autores(21) apresentaram danos retinianos irreversíveis após exposição de TB em modelos bovinos e dois grupos de pesquisa observaram toxicidade in vitro em células neurossensoriais de roedores, dose-dependente(22), em contraste com trabalhos in vitro de exposição às células do EPR, mesmo em doses mais baixas(23). Um novo uso do TB é para visibilidade de bordas de roturas em cirurgias de descolamento de retina regmatogênico(24). Investigações futuras devem ser realizadas para maiores esclarecimentos de toxicidade e dose segura do TB.
Triancinolona acetonida
É um corticóide sintético insolúvel. Triancinolona acetonida (TA) pode ser indicada para o tratamento de várias doenças da retina, tais como edema macular e degeneração macular relacionada à idade. O esteróide branco tem sido utilizado como alternativa de corante em cromovitrectomia desde 2003 para visibilidade do vítreo transparente e o seu córtex posterior(25). Um estudo recente(26) comparou a eficácia de quatro corantes vitais (triancinolona acetonida, fluoresceína, ICG, e azul tripan) no vítreo e a coloração como um meio para facilitar a sua remoção. A TA se mostrou como o melhor corante para se ver o vítreo. Os cristais de TA podem se depositar sobre a MER e a MLI, facilitando a identificação.
A segurança da TA tem sido demonstrada em vários estudos in vitro e in vivo(27). Injeções intravítreas em altas concentrações (maior que 30 mg) não demonstraram nenhuma toxicidade relevante. Em nossos trabalhos, a TA sem preservativo injetada na cavidade sub-retiniana de coelhos não demonstrou toxicidade relevante(28). Foi proposto, recentemente, que o preservativo álcool benzílico presente no veículo da TA seria responsável pela indução de lesões retinianas(29). Embora alguns autores proponham que os cristais de triancinolona podem servir para melhorar a visibilidade da MER e MLI(26), a triancinolona sem preservativo é recomendada para corar vítreo apenas.
Azul patente
O azul patente (PB) é um marcador azul fluorescente que permite a visibilidade de linfonodos para remoção e identificação de fungos in vitro. O corante foi aprovado para corar a cápsula anterior de cristalino, em cirurgia de catarata, na concentração de 0,24%. PB não representa risco sistêmico, carcinogenicidade e mutagenicidade(29). Estudos preliminares em animais e os dados clínicos demonstraram uma moderada afinidade do PB para MER e vítreo, mas uma má afinidade com a MLI (dados não publicados). Nossos dados clínicos recentes(30) revelaram o PB como um bom corante para uso em tecido glial de MER de várias etiologias em indicações parecidas com as do azul tripan.
Estudos toxicológicos revelaram dados conflitantes referentes à toxicidade retiniana. Em um estudo o azul patente foi responsável por apenas uma toxicidade moderada e reversível à retina enquanto células do EPR expostas ao PB in vitro não apresentaram sinais de toxicidade(30). Embora nenhuma conclusão possa ser definida, o PB parece se mostrar mais seguro que que o azul tripan, particularmente em células neurorretinianas. Nossos modelos de toxicidade sub-retiniana não demonstraram alterações significantes do EPR à angiofluoresceinografia após injeções sub-retinianas da droga em coelhos, similares ao controle com solução salina balanceada(13). Histologicamente, a injeção sub-retiniana de azul patente resultou apenas em danos microestruturais na retina durante o acompanhamento. As lesões causadas pelo azul tripan foram muito mais intensas que pelo PB. Nosso grupo de investigação realizou experimentos semelhantes com outros corantes vitais incluindo TB, IfCG, ICG, e TA e considerou o TB e a ICG como os mais tóxicos. A dosagem segura do azul patente continua incerta.
Azul brilhante G
O corante sintético foi certificado como corante alimentar na Europa e pode ser usado como marcador cardiovasculares e de proteínas em doenças neurológicas(31). Dados sobre a utilização de azul brilhante G (BBG) para cromovitrectomia e cirurgia de catarata foram lançados em 2006(32). A fim de permitir a visualização da cápsula anteror para capsulorrexis, BBG deve ser injetado como solução iso-osmolar em concentrações de 0,25 mg/ml ou superior. Em olhos de ratos nenhum dano, incluindo apoptose, morte ou degeneração das células endoteliais na córnea foram observado a longo prazo(33).
Em cromovitrectomia o perfil de segurança do BBG foi investigado por alguns autores(34) em experimentos pré-clínicos em ratos e primatas e não foram observadas alterações patológicas à microscopia óptica ou eletrônica com pequenas doses injetadas de BBG. Também não houve redução da amplitude das ondas do eletrorretinograma. No ser humano BBG tem promovido uma adequada coloração da MLI em uma solução iso-osmolar de 0,25 mg/ml para MER e tratamento de buracos maculares com 85% dos pacientes melhorando, pelo menos, duas linhas de Snellen. Em acompanhamentos de longo prazo não foram observados sinais de toxicidade(33). Em resumo, BBG surge como a primeira alternativa real à ICG e IfCG em cromovitrectomia devido à sua notável afinidade para MLI, embora seus limitados dados sobre toxicidade demandem novas investigações.
Azul de bromofenol
Azul de bromofenol (BrB) é um corante usado como indicador ácido-base ou marcador para procedimentos em gel de eletroforese. Utilizado de forma endovenosa em experimentos com ratos, o BrB corou tumores cerebrais auxiliando sua visibilidade em procedimentos cirúrgicos(34). Tem um grande potencial em uso de cirurgia de catarata, pois em experimentos usando a concentração de 0,2% o BrB corou intensamente a cápsula cristaliniana em olhos de porco.
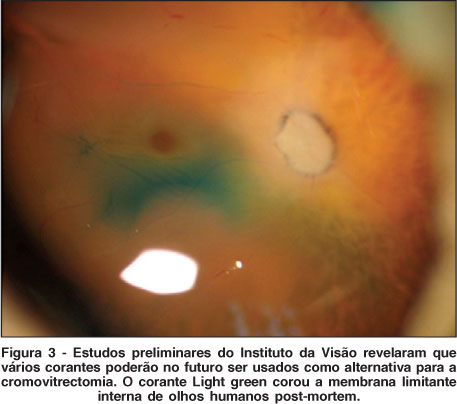
Experimentos recentes propuseram um potencial uso do BrB em cromovitrectomia. Estudos pré-clínicos mostraram que o BrB corou bem a MLI, MER e não causou danos em células retinianas in vitro em concentrações de 0,2 a 0,02%(35). Estudos em roedores e porcos mostraram com concentrações de 0,5% e 0,02% menos lesões tóxicas à retina (visto à histologia e à contagem de células ganglionares) que outros três corantes testados (light-green - Figura 3, Azul Chicago e E68), além de ter se mostrado superior na capacidade de corar a MLI e a MER(36). Mais pesquisas são necessárias com o uso em humanos e comparando com demais corantes já comercializados.
Fluoresceína sódica
A fluoresceína sódica (SF) mostra-se muito segura para o uso em angiografia de fundo nas concentrações de 5-25% além de ser amplamente utilizada como colírio para visualizar lesões corneais. A SF tem absorção de espectro máxima a 490 nm e emissão máxima em 514 nm com água. Enquanto muitos fluorocromos fluorescem naturalmente, a SF é potencializada mediante luz azul. O vítreo acelular participa de várias doenças vitreorretinianas e sua remoção completa garante melhor prognóstico cirúrgico. Em meados de 1978 uns autores reportaram(37) que a SF cora bem o vítreo e facilita sua visibilidade assegurando sua total remoção durante a cromovitrectomia; tal hipótese foi confirmada em uma recente série de casos(26). A toxicidade da SF para a retina necessita de mais dados por parte da literatura.
Acetato de fluormetolona
O acetato de fluormetolona (FMA) pode ser preparado como uma suspensão oftálmica. Este esteróide branco pode ser usado para o tratamento de inflamações conjuntivais, corneais e de segmento anterior do olho em geral. Outros autores investigaram a segurança intravítrea e sub-retiniana do FMA em primatas e ratos para possível uso em vitrectomia e não observou alterações histológicas ou eletrorretinográficas que sugerissem toxicidade retiniana, concluindo que o FMA seria uma alternativa útil na cromovitrectomia(38).
Técnicas cirúrgicas e instrumentos em cromovitrectomia
Várias técnicas cirúrgicas têm sido utilizadas para injetar corantes. Uma técnica tem sido chamada troca fluido-gasosa onde se retira o líquido da cavidade vítrea antes da aplicação do corante. Esta técnica tem a vantagem de manter o corante concentrado no polo posterior evitando que a cápsula posterior do cristalino se core. Uma segunda técnica proposta é a manutenção de solução salina balanceada na cavidade vítrea para a injeção do corante. Esta técnica permite que o corante seja "lavado" da cavidade vítrea imediatamente após sua injeção(1). Investigações dos efeitos da ICG na retina de modelos de porco através da injeção da ICG intravítrea utilizando estes dois métodos evidenciou uma alta taxa de atrofia de EPR e degeneração de segmento externo da retina no grupo que fez a técnica de troca fluido-gasosa antes da injeção de corante quando comparada com a técnica de preenchimento com solução salina balanceada(6). Os corantes vitais, na cromovitrectomia, devem ser retirados o quanto antes da cavidade vítrea para reduzir ao máximo o tempo contato deste com a retina para que se melhore o prognóstico visual final(1,39). Os cirurgiões devem evitar o contato dos corantes vitais com as células neurorretinianas através da injeção de corante após a retirada da MLI, além disso, tem sido sugerido que a diluição de vários corantes, incluindo o azul tripan, com veículos de alta densidade, como a glicose 5%, facilitaria o decantamento do corante sobre as membranas pré-retinianas por efeito gravitacional evitando a dispersão pela cavidade vítrea.
Um novo aplicador chamado VINCE (vitreorretinal internal limiting membrane enhancer) tem sido recentemente comercializada permitindo a pintura dos tecidos pré-retinianos. O pincel é constituído de um tubo de silicone acoplado a uma cânula metálica de 20-gauge. O corante diluído é liberado por um cartucho de silicone descartável. A ponta flexível contendo o corante passa suavemente sobre a retina causando perda mínima de MLI. Tal técnica permite que se possa corar estruturas na superfície retiniana semitransparentes delicadas evitando uso excessivo e pouco seletivo de corante(40).
CONCLUSÃO
A cromovitrectomia facilitou a visibilidade de estruturas pré-retinianas e membranas. A ICG teve um importante papel como pioneira no uso para remoção de MLI em cromovitrectomia, porém, mais pesquisas são necessárias para que se avalie seu perfil de segurança. A recomendação atual para realização da cromovitrectomia com ICG consiste no uso em baixas concentrações, pouco tempo de permanência do corante dentro do olho e sem exposição concomitante do foco luminoso. Uma abordagem semelhante tem sido proposta aos novos corantes. Algumas investigações recentes mostram que a IfCG é mais segura que ICG para cirurgia de retirada de MLI, enquanto o azul tripan e o azul patente são boas escolhas para identificação da MER. Dados clínicos recentes mostram o BrB e o BBG como potenciais opções para corar estruturas pré-retinianas e membranas, enquanto corantes com menor utilidade para cromovitrectomia incluem a rodamina 6G e o azul de rodulina. A triancinolona acetonida ainda é o padrão-ouro para visibilidade do vítreo, enquanto a fluoresceína sódica ou o acetato de fluormetolona surgem como uma boa alternativa. Em nossos experimentos preliminares, o cristal violeta e o vermelho do Congo apresentaram-se como alternativas para visibilidade do vítreo. O novo campo da cromovitrectomia oferece grandes oportunidades de pesquisa na oftalmologia.
REFERÊNCIAS
1. Rodrigues EB, Meyer CH, Farah ME, Kroll P. Intravitreal staining of the internal limiting membrane using indocyanine green in the treatment of macular holes. Ophthalmologica. 2005;219(5):251-62.
2. Teba FA, Mohr A, Eckardt C, et al. Trypan blue staining in vitreoretinal surgery. Ophthalmology. 2003;110(12):2409-12.
3. Desmettre T, Devoisselle JM, Mordon S. Fluorescence properties and metabolic features of indocyanine green (ICG) as related to angiography. Surv Ophthalmol. 2000;45(1):15-27.
4. Rodrigues EB, Meyer CH. Meta-analysis of chromovitrectomy with indocyanine green in macular hole surgery. Ophthalmologica. 2008;222(2):123-9.
5. Rodrigues EB, Meyer CH, Schmidt JC, Kroll P. Surgical management of epiretinal membrane with indocyanine-green-assisted peeling. Ophthalmologica. 2004;218(1):73-4.
6. Czajka MP, McCuen BW, 2nd, Cummings TJ, Nguyen H, Stinnett S, Wong F. Effects of indocyanine green on the retina and retinal pigment epithelium in a porcine model of retinal hole. Retina. 2004;24(2):275-82.
7. Iriyama A, Uchida S, Yanagi Y, et al. Effects of indocyanine green on retinal ganglion cells. Invest Ophthalmol Vis Sci. 2004;45(3):943-7.
8. Jackson TL, Hillenkamp J, Knight BC, et al. Safety testing of indocyanine green and trypan blue using retinal pigment epithelium and glial cell cultures. Invest Ophthalmol Vis Sci. 2004;45(8):2778-85.
9. Maia M, Kellner L, de Juan E, Jr., et al. Effects of indocyanine green injection on the retinal surface and into the subretinal space in rabbits. Retina. 2004; 24(1):80-91.
10. Maia M, Margalit E, Lakhanpal R, et al. Effects of intravitreal indocyanine green injection in rabbits. Retina. 2004;24(1):69-79.
11. Kwok AK, Li WW, Pang CP, et al. Indocyanine green staining and removal of internal limiting membrane in macular hole surgery: histology and outcome. Am J Ophthalmol. 2001;132(2):178-83.
12. Stalmans P, Van Aken EH, Veckeneer M, Feron EJ, Stalmans I. Toxic effect of indocyanine green on retinal pigment epithelium related to osmotic effects of the solvent. Am J Ophthalmol. 2002;134(2):282-5.
13. Penha MF, Maia M, Principe A, Freymuller E, Farah ME. Efeitos da injeção sub-retiniana de indocianina verde, azul de tripan, triancinolona e glicose: qual o corante ideal para a cirurgia do buraco macular? Arq Bras Oftalmol. 2005; 68(Supl 4):54. Apresentado no 33º Congresso Brasileiro de Oftalmologia, 2005. Fortaleza, 3-6 set.
14. Sheidow TG, Blinder KJ, Holekamp N, et al. Outcome results in macular hole surgery: an evaluation of internal limiting membrane peeling with and without indocyanine green. Ophthalmology. 2003;110(9):1697-701.
15. Ando F, Sasano K, Ohba N, Hirose H, Yasui O. Anatomic and visual outcomes after indocyanine green-assisted peeling of the retinal internal limiting membrane in idiopathic macular hole surgery. Am J Ophthalmol. 2004;137(4): 609-14.
16. Hillenkamp J, Saikia P, Herrmann WA, Framme C, Gabel VP, Sachs HG. Surgical removal of idiopathic epiretinal membrane with or without the assistance of indocyanine green: a randomised controlled clinical trial. Graefes Arch Clin Exp Ophthalmol. 2007;245(7):973-9.
17. Jackson TL, Vote B, Knight BC, El-Amir A, Stanford MR, Marshall J. Safety testing of infracyanine green using retinal pigment epithelium and glial cell cultures. Invest Ophthalmol Vis Sci. 2004;45(10):3697-703.
18. Ullern M, Roman S, Dhalluin JF, et al. [Contribution of intravitreal infracyanine green to macular hole and epimacular membrane surgery: preliminary study]. J Fr Ophtalmol. 2002;25(9):915-20. French
19. Veckeneer M, van Overdam K, Monzer J, et al. Ocular toxicity study of trypan blue injected into the vitreous cavity of rabbit eyes. Graefes Arch Clin Exp Ophthalmol. 2001;239(9):698-704.
20. Rebolleda G, Munoz Negrete FJ, Suarez-Figueroa M. Trypan blue staining in vitreoretinal surgery. Ophthalmology. 2004;111(8):1622-23; author reply 1623.
21. Luke C, Luke M, Dietlein TS, et al. Retinal tolerance to dyes. Br J Ophthalmol. 2005;89(9):1188-91.
22. Narayanan R, Kenney MC, Kamjoo S, et al. Trypan blue: effect on retinal pigment epithelial and neurosensory retinal cells. Invest Ophthalmol Vis Sci. 2005;46(1):304-9.
23. Mennel S, Thumann G, Peter S, Meyer CH, Kroll P. [Influence of vital dyes on the function of the outer blood-retinal barrier in vitro]. Klin Monatsbl Augenheilkd. 2006;223(7):568-76. German
24. Jackson TL, Kwan AS, Laidlaw AH, Aylward W. Identification of retinal breaks using subretinal trypan blue injection. Ophthalmology. 2007;114(3): 587-90.
25. Burk SE, Da Mata AP, Snyder ME, Schneider S, Osher RH, Cionni RJ. Visualizing vitreous using Kenalog suspension. J Cataract Refract Surg. 2003; 29(4):645-51.
26. Guo S, Tutela AC, Wagner R, Caputo AR. A comparison of the effectiveness of four biostains in enhancing visualization of the vitreous. J Pediatr Ophthalmol Strabismus. 2006;43(5):281-4.
27. Narayanan R, Mungcal JK, Kenney MC, Seigel GM, Kuppermann BD. Toxicity of triamcinolone acetonide on retinal neurosensory and pigment epithelial cells. Invest Ophthalmol Vis Sci. 2006;47(2):722-8.
28. Ruiz-Moreno JM, Montero JA, Bayon A, Rueda J, Vidal M. Retinal toxicity of intravitreal triamcinolone acetonide at high doses in the rabbit. Exp Eye Res. 2007;84(2):342-8.
29. Sokolowski J, Engeset A. Toxic effect of patent blue violet on rat lymph node lymphocytes. Lymphology. 1974;7(1):28-31.
30. Mennel S, Meyer CH, Tietjen A, Rodrigues EB, Schmidt JC. Patent blue: a novel vital dye in vitreoretinal surgery. Ophthalmologica. 2006;220(3):190-3.
31. Westermeier R. Sensitive, quantitative, and fast modifications for coomassie blue staining of polyacrylamide gels. Proteomics. 2006;6(Suppl 2):61-4.
32. Hisatomi T, Enaida H, Matsumoto H, et al. Staining ability and biocompatibility of brilliant blue G: preclinical study of brilliant blue G as an adjunct for capsular staining. Arch Ophthalmol. 2006;124(4):514-9.
33. Enaida H, Hisatomi T, Hata Y, et al. Brilliant blue G selectively stains the internal limiting membrane/brilliant blue G-assisted membrane peeling. Retina. 2006;26(6):631-6.
34. Ozawa T, Britz GW, Kinder DH, et al. Bromophenol blue staining of tumors in a rat glioma model. Neurosurgery. 2005;57(5):1041-7; discussion 1041-7.
35. Haritoglou C, Yu A, Freyer W, et al. An evaluation of novel vital dyes for intraocular surgery. Invest Ophthalmol Vis Sci. 2005;46(9):3315-22.
36. Schuettauf F, Haritoglou C, May CA, et al. Administration of novel dyes for intraocular surgery: an in vivo toxicity animal study. Invest Ophthalmol Vis Sci. 2006;47(8):3573-8.
37. Abrams GW, Topping T, Machemer R. An improved method for practice vitrectomy. Arch Ophthalmol. 1978;96(3):521-5.
38. Hata Y, Enaida H, Sassa Y, et al. Preclinical investigation of fluorometholone acetate as a potential new adjuvant during vitreous surgery. Graefes Arch Clin Exp Ophthalmol. 2007;245(7):1019-25.
39. Lochhead J, Jones E, Chui D, et al. Outcome of ICG-assisted ILM peel in macular hole surgery. Eye. 2004;18(8):804-8.
40. Meyer CH, Rodrigues EB. A novel applicator for the selective painting of pre-retinal structures during vitreoretinal surgery. Graefes Arch Clin Exp Ophthalmol. 2005;243(5):487-9.
Endereço para correspondência:
Eduardo Dib
Rua Doutor Diogo de Faria, 917/73
São Paulo (SP)
CEP 04037-003
E-mail: [email protected]
Recebido para publicação em 27.10.2007
Última versão recebida em 24.05.2009
Aprovação em 02.07.2009
Suporte financeiro: Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP).
Trabalho realizado no Instituto da Visão (IPEPO), Departamento de Oftalmologia da Universidade Federal de São Paulo - UNIFESP - São Paulo (SP) - Brasil.
Interesse de propriedade: Dr. Eduardo B. Rodrigues e Dr. Carsten H. Meyer têm a patente do VINCE em conjunto com a Dutch Ophthalmics, Holanda.