

Otacílio de Oliveira Maia Júnior1; Walter Yukihiko Takahashi2; Tiago Eugênio Faria e Arantes3; Raquel Barbosa Paes Barreto4; João Lins de Andrade Neto5
DOI: 10.1590/S0004-27492008000100002
RESUMO
OBJETIVO: Avaliar dano estrutural macular na doença de Stargardt por meio da tomografia de coerência óptica, correlacionando-o com acuidade visual e duração da doença. MÉTODOS: Foram incluídos portadores da doença de Stargardt, submetidos à medida da acuidade visual (logMAR) e exames complementares (retinografia, angiofluoresceinografia e tomografia de coerência óptica). Todos os casos foram reexaminados para confirmação diagnóstica, sendo determinada duração da doença. O grupo controle foi composto pelo mesmo número de casos, pareados por sexo, idade e sem qualquer alteração oftalmológica. RESULTADOS: A amostra foi composta por 22 pacientes (44 olhos), sendo 11 (50%) do sexo masculino e 11 (50%), do feminino. A duração da doença variou de 3 a 21 anos (média de 11,4 ± 5,3 anos). Os grupos não apresentaram diferença significante na idade (p=0,98) e no sexo. O grupo caso apresentou valores de espessura macular na tomografia de coerência óptica significativamente menores em relação ao grupo controle (p<0,001). Foi evidenciada correlação negativa entre duração da doença e espessura macular na tomografia de coerência óptica (r=-0,57 e p=0,005). Houve correlação positiva entre duração da doença e acuidade visual (r=0,50 e p=0,0167) e correlação negativa entre acuidade visual e espessura macular na tomografia de coerência óptica (r=-0,83 e p=0,0001). CONCLUSÃO: Evidenciou-se que portadores da doença de Stargardt possuem menor espessura macular quando comparados a indivíduos normais, e esta redução está relacionada com tempo de duração da doença. Adicionalmente, tanto a espessura quanto a duração da doença influenciam no prognóstico visual dos pacientes.
Descritores: Retina; Macula lútea; Degeneração retiniana; Angiofluoresceinografia; Tomografia de coerência óptica; Acuidade visual
ABSTRACT
PURPOSE: To evaluate de macular structural damage in Stargardt's disease by optical coherence tomography, correlating with visual acuity and disease duration. METHODS: Patients with Stargardt's disease were included and submitted to visual acuity (logMAR) measurement and complementary examinations performed were color fundus photographs, fluorescein angiography and optical coherence tomography. All cases were reexamined for diagnostic confirmation and the duration of symptoms was determined. The control group was composed of the same number of subjects, matched by sex and age, without any ophthalmologic alteration. RESULTS: The sample was composed of 22 patients (44 eyes) with Stargardt's disease, 11 (50%) males and 11 (50%) females. The duration of the disease varied from 3 to 21 years (mean of 11.4 ± 5.3 years). The groups did not show significant differences in age (p= 0.98) and sex. Concerning the macular thickness in optical coherence tomography, the variation in the study group differed significantly from the control group, presenting smaller values of thickness (p<0.001). There was negative and significant correlation between the duration of disease and the macular thickness assessed by optical coherence tomography (r=-0.57 and p=0.005). There was positive correlation between the duration of the disease and the visual acuity (r=0.50 and p=0.0167) and negative correlation between the visual acuity and the macular thickness in optical coherence tomography (r=-0.83 and p=0.0001). CONCLUSION: It was evidenced that patients with Stargardt's disease have a thinner macular thickness when compared to normal subjects, and this reduction is related to the duration of symptoms of the disease. Additionally, the thickness and also the duration of the disease influence the visual prognosis of the patients.
Keywords: Retina; Macula lutea; Retinal degeneration; Fluorescein angiography; Tomography, optical coherence; Visual acuity
INTRODUÇÃO
A distrofia macular de Stargardt foi descrita primeiramente em 1909, pelo alemão Karl Stargardt(1), caracterizada por redução progressiva e grave da visão central, tipicamente na primeira e segunda década de vida(2-3). Em 1963, o termo fundus flavimaculatus foi introduzido por Franceschetti (4) e acredita-se que, atualmente, a distrofia macular de Stargardt e fundus flavimaculatus representam expressões diferentes da mesma desordem(5), denominada doença de Stargardt, responsável por até 7% das distrofias maculares(2). Geralmente é herdada de forma autossômica recessiva por mutações no gene ABCA4, localizado no cromossomo 1, região p13-p21, cujo produto protéico está envolvido no transporte ATP-dependente da membrana tanto de cones quanto de bastonetes, contudo existe grande heterogeneidade genética(6).
O epitélio pigmentado da retina (EPR) e a camada de fotorreceptores da região macular são os sítios mais comprometidos(7-8). O aspecto fundoscópico clássico da doença é de lesões maculares em bronze batido e lesões pisciformes branco-amareladas ("flecks"), correspondentes ao acúmulo de lipofuscina no pólo apical das células do EPR(3,9). No fundus flavimaculatus são descritos "flecks" dispersos no pólo posterior, que se extendem até a média periferia, podendo ser encontradas alterações maculares em 50% dos pacientes(4-5). A diminuição da acuidade visual freqüentemente precede alterações fundoscópicas(3) e depende da idade do início dos sintomas: quanto mais tardio o aparecimento, menor probabilidade de perda visual(10). No estágio final da doença, a acuidade visual para longe se estabiliza em aproximadamente 20/200(10).
O diagnóstico da doença de Stargardt é baseado a partir da história clínica e por alterações fundoscópicas (descritos anteriormente), tendo os exames complementares importância relevante neste contexto. A angiofluoresceinografia (AFG) é um método propedêutico muito utilizado e pode firmar o diagnóstico de Stargardt, pois são observados com mais evidência lesões pisciformes hiperfluorescentes ("flecks"), graus variados de atrofia macular (podendo apresentar aspecto em "bulls eye") e o silêncio coroideo (hipofluorescência por bloqueio da coriocapilar, devido ao acúmulo de lipofuscina no EPR), presente em torno de 80% dos casos que, praticamente, sela o diagnóstico, embora a ausência não exclua tal doença(5,11). O eletrorretinograma (ERG) padrão e o eletrooculograma não representam ferramentas diagnósticas de grande valor, pois a perda funcional está inicialmente restrita a áreas circunscritas da retina. O ERG multifocal tem se mostrado útil em detectar disfunção foveal na doença de Stargardt, mesmo em estágios precoces, mostrando-se importante no diagnóstico e ajudando a descrever a topografia da perda de atividade dos cones mais precisamente(7).
Recentemente, a tomografia de coerência óptica, também conhecida pela sigla em inglês OCT, método diagnóstico que permite fornecer imagens de alta resolução das estruturas retinianas seccionadas transversalmente(12), vem sendo utilizada para detectar alterações maculares nas distrofias retinianas(13-15). Acredita-se que ERG multifocal e OCT possibilitam quantificar alterações intra-retinianas em fases precoces da doença de Stargardt, auxiliando no prognóstico para o doente.
O presente estudo objetiva avaliar dano estrutural macular na doença de Stargardt por meio da tomografia de coerência óptica, correlacionando-o com acuidade visual e duração da doença. Este trabalho faz parte de pesquisa mais ampla a respeito do tema.
MÉTODOS
Foram incluídos portadores da doença de Stargardt, acompanhados ou recém-diagnosticados nos setores de retina e de visão subnormal do Departamento de Oftalmologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP). O grupo controle foi composto pelo mesmo número de casos, pareados por sexo, idade e sem qualquer alteração oftalmológica ou história prévia de uso de medicamentos causadores de maculopatia. Os critérios de exclusão dos casos foram: dúvida diagnóstica, uso de medicação sistêmica de comprovada ação retinotóxica, degeneração macular relacionada à idade ou outras maculopatias e opacidade de meios que interferissem na realização de exames.
Os pacientes foram submetidos, inicialmente, à medida da acuidade visual com melhor correção em logMAR (segundo a tabela do ETDRS - Early Treatment Diabetic Retinopathy Study), e exame oftalmológico completo, incluindo a biomicroscopia da mácula. Os exames complementares realizados foram retinografia, AFG e OCT da mácula. Considerouse ambos os olhos de cada paciente para análises estatísticas.
Todos os casos foram reexaminados para confirmação diagnóstica, sendo determinadas duração da doença (definida pela diferença entre a idade atual à de início dos sintomas) e alterações na AFG. Os pacientes foram classificados de acordo com Fishman et al.(16): Fenótipo I - pacientes com lesão foveal de aspecto atrófico, geralmente pequena, rodeada por "flecks" para e perifoveais restritas à região macular (definida como a região entre as arcadas temporais); Fenótipo II - numerosos "flecks" dispersos no pólo posterior e além das arcadas e Fenótipo III - pacientes com extensas atrofia do EPR, atrofia de coróide ou espículas ósseas além da região macular.
As imagens obtidas pelo Stratus OCT versão 4.0 (Carl Zeiss Meditec) foram realizadas no programa de medida da espessura retiniana ("macular thickness") e o cursor foi colocado manualmente no centro da fóvea, quando a depressão foveal era visível. A estratégia para análise foi da espessura macular, mensurada na região central da retina, sendo utilizados limites anterior (interface vítreo-retiniana) e posterior (superfície anterior do EPR) determinados pelo aparelho para quantificar espessura retiniana, demonstrada no "Thickness Charts" (Figura 1).
Inicialmente todas as variáveis foram analisadas descritivamente. Para as variáveis quantitativas (idade, duração da doença, espessura macular), esta análise foi feita por meio da observação dos valores mínimos e máximos e do cálculo de médias, desvios-padrão e medianas. Para as variáveis qualitativas (sexo, fenótipo, início da doença), calcularam-se freqüências absolutas e relativas. Para análise da hipótese de igualdade entre os grupos, utilizou-se o teste qui-quadrado(17). Para estudo de correlações entre duas variáveis, foi utilizado o coeficiente de correlação de Pearson(17). O nível de significância utilizado para os testes foi de 5%. O estudo foi aprovado pela Comissão de Ética para Análise de Projetos e Pesquisa da Diretoria Clínica do HC-FMUSP.
RESULTADOS
O resumo das características dos pacientes está demonstrado na tabela 1. A amostra foi composta por 22 portadores da doença de Stargardt (44 olhos), com a seguinte classificação fundoscópica: 7 pacientes com Fenótipo I, 12 com Fenótipo II e 3 com o III. A duração da doença variou de 3 a 21 anos (média de 11,4 ± 5,3 anos, mediana de 11 anos), sendo que 50% iniciaram o quadro na primeira ou segunda década de vida.
A acuidade visual variou de 0,02 a 1,6 (média de 0,96 ± 0,46, mediana de 0,97) no grupo de portadores da doença e no grupo controle, todos apresentaram acuidade de 0,00. A idade variou entre 19 e 61 anos (média de 34,3 ± 11,1 anos, mediana de 30 anos) no grupo caso e de 20 a 60 anos (média de 34,3 ± 10,5 anos, mediana de 30,5 anos) no grupo controle. O grupo caso teve 11 (50%) pacientes do sexo masculino e 11 (50%) do feminino, tendo o grupo controle igual distribuição. Os grupos não apresentaram diferença estatisticamente significante na idade (p=0,98) e no sexo. Quanto à espessura macular no OCT, a variação no grupo caso foi de 60 a 167 µm (média de 103,3 ± 30,2 µm, mediana de 95,5 µm), diferindo significativamente do grupo controle, que variou de 168 a 236 µm (média de 204,8 ± 18,5 µm, mediana de 204 µm), por apresentar valores menores na espessura (p<0,001) (Figura 1).
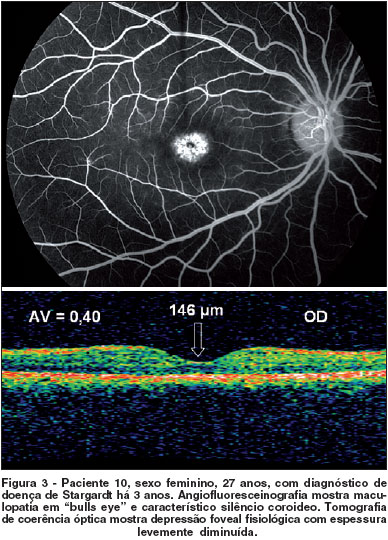
Na AFG, o silêncio coroidal esteve presente em 26 olhos (59%) e a maculopatia em "bulls eye", 17 olhos (38,6%) (Figura 2). A presença de "flecks" na retinografia foi observada na maioria dos casos, 88,6% (39 olhos).
A análise de correlações evidenciou correlação negativa e estatisticamente significante entre duração da doença e espessura macular no OCT (r=-0,57 e p=0,005); assim, quanto maior tempo de duração, menor espessura e vice-versa. Houve correlação positiva entre duração da doença e acuidade visual (r=0,50 e p=0,0167), ou seja, quanto maior duração da doença, pior acuidade em logMAR e vice-versa. Adicionalmente, houve correlação negativa entre acuidade visual e espessura macular no OCT (r=-0,83 e p=0,0001); assim, quanto pior acuidade em logMAR, menor espessura e vice-versa (Figura 3).
DISCUSSÃO
Acredita-se que a degeneração retiniana observada na doença de Stargardt seja causada pelo acúmulo de lipofuscina no EPR, resultando em morte de células do EPR e de fotorreceptores, levando às lesões atróficas observadas na mácula no estágio final da doença(9). O OCT proporciona uma avaliação quantitativa in vivo das camadas retinianas, com boa correlação entre imagens obtidas e estrutura anatômica correspondente, permitindo melhor avaliação das alterações maculares.
A espessura macular em pacientes normais não é uniforme nas diferentes versões do OCT(18-19). Recentemente, Chan et al.(18) reportaram que, utilizando Stratus OCT, a espessura foveal central em pacientes normais variava em média de 182 ± 23 µm, quando determinada automaticamente pelo aparelho e de 170± 18 µm, quando determinada manualmente. No presente estudo, apesar dos portadores da doença de Stargardt apresentarem diminuição da espessura macular em concordância com estudos anteriores, optou-se por comparar tais pacientes com grupo controle. Para tal, tanto a delimitação da espessura quanto sua análise foram determinadas pelo Stratus OCT na região central da fóvea, podendo ter hiperestimado a medida de espessura para os dois grupos. Entretanto, se a espessura fosse determinada manualmente por meio do "caliper", ocorreria um erro de aferição ainda maior, devido à dificuldade técnica de determinar limites (anterior e posterior) retinianos nos portadores de atrofia macular, fundamental para quantificá-la. De forma similar, Hargitai et al.(9) avaliaram estruturalmente portadores de Stargardt por meio do OCT, centrando o scan da tomografia manualmente e calculando a espessura pelo software do aparelho.
A redução da acuidade visual em relação ao tempo de duração da doença, está em concordância com dados prévios na literatura(20-21); contudo foi evidenciada, neste estudo, redução quantitativa na espessura macular relacionada com maior tempo de doença, podendo justificar tal diminuição na acuidade, visto que se obteve correlação negativa significante entre estas variáveis(8-9). Apesar de ser um dado subjetivo, o cálculo da duração foi realizado conforme publicações anteriores(9), sendo compatível com início da sintomatologia em metade dos 71(1) pacientes, na primeira ou segunda década de vida. Outra evidência demonstrada foi redução da espessura foveal nos pacientes, quando comparado ao grupo controle, denotando atrofia macular presente nos portadores de Stargardt, a qual se relaciona com o prognóstico visual da doença.
CONCLUSÃO
Evidenciou-se que portadores da doença de Stargardt possuem menor espessura macular quando comparados com indivíduos normais, e esta redução está relacionada com tempo de duração da doença. Adicionalmente, tanto espessura quanto duração da doença influenciam no prognóstico visual dos pacientes. Assim, o OCT pode ser incorporado ao arsenal propedêutico no seguimento destes, quantificando o grau de atrofia macular presente, contribuindo para melhor avaliação prognóstica da doença.
REFERÊNCIAS
1. Stargardt K. Über familiare, progressive Degeneration in der Maculagegend des Auges. Albrecht von Graefes Arch Klin Exp Ophthalmol.1909;71:534-50.
2. Gerth C, Andrassi-Darida M, Bock M, Preising MN, Weber BH, Lorenz B. Phenotypes of 16 Stargardt macular dystrophy/fundus flavimaculatus patients with known ABCA4 mutations and evaluation of genotype-phenotype correlation. Graefes Arch Clin Exp Ophthalmol. 2002;240(8):628-38.
3. Wirtitsch MG, Ergun E, Hermann B, Unterhuber A, Stur M, Scholda C, et al. Ultrahigh resolution optical coherence tomography in macular dystrophy. Am J Ophthalmol. 2005;140(6):976-83.
4. Franceschetti A. Über tapeto-retinale. Degenerationen im Kindesalter: Dritter Fortbildungs-kurs der Deutschen Ophthalmologischen Gesellschaft, Hamburg 1962. In: Sautter H, editor. Entwicklung und Fortschrift in der Augenheilkunde. Stuttgart: Enke; 1963. p.107-20.
5. Noble KG, Carr RE. Stargardt's disease and fundus flavimaculatus. Arch Ophthalmol. 1979;97(7):1281-5.
6. Hubbard AF, Askew EW, Singh N, Leppert M, Bernstein PS. Association of adipose and red blood cell lipids with severity of dominant Stargardt macular dystrophy (STGD3) secondary to an ELOVL4 mutation. Arch Ophthalmol. 2006;124(2):257-63.
7. Kretschmann U, Seeliger MW, Ruether K, Usui T, Apfelstedt-Sylla E, Zrenner E. Multifocal electroretinography in patients with Stargardt's macular dystrophy. Br J Ophthalmol. 1998;82(3):267-75.
8. Ergun E, Hermann B, Wirtitsch M, Unterhuber A, Ko TH, Sattmann H, et al. Assessment of central visual function in Stargardt's disease/fundus flavimaculatus with ultrahigh-resolution optical coherence tomography. Invest Ophthalmol Vis Sci. 2005;46(1):310-6.
9. Hargitai J, Zernant J, Somfai GM, Vamos R, Farkas A, Salacz G, Allikmets R. Correlation of clinical and genetic findings in Hungarian patients with Stargardt disease. Invest Ophthalmol Vis Sci. 2005;46(12):4402-8.
10. Rotenstreich Y, Fishman GA, Anderson RJ. Visual acuity loss and clinical observations in a large series of patients with Stargardt disease. Ophthalmology. 2003;110(6):1151-8.
11. Oh KT, Weleber RG, Oh DM, Billingslea AM, Rosenow J, Stone EM. Clinical phenotype as a prognostic factor in Stargardt disease. Retina. 2004; 24(2):254-62.
12. Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W, et al. Optical coherence tomography. Science. 1991;254(5035):1178-81.
13. Pierro L, Tremolada G, Introini U, Calori G, Brancato R. Optical coherence tomography findings in adult-onset foveomacular vitelliform dystrophy. Am J Ophthalmol. 2002;134(5):675-80.
14. Benhamou N, Souied EH, Zolf R, Coscas F, Coscas G, Soubrane G. Adult-onset foveomacular vitelliform dystrophy: a study by optical coherence tomography. Am J Ophthalmol. 2003;135(3):362-7.
15. Samsel A, Dróbecka-Brydak E, Brydak-Godowska J, Ciszewska J, Kecik D. [Optical coherence tomography in Stargardt's dystrophy]. Klin Oczna. 2005; 107(10-12):668-71. Polish.
16. Fishman GA, Stone EM, Grover S, Derlacki DJ, Haines HL, Hockey RR. Variation of clinical expression in patients with Stargardt dystrophy and sequence variations in the ABCR gene. Arch Ophthalmol. 1999;117(4): 504-10.
17. Rosner B. Fundamentals of biostatistics. 2nd ed. Boston: PWS Publishers; 1986. 584p.
18. Chan A, Duker JS, Ko TH, Fujimoto JG, Schuman JS. Normal macular thickness measurements in healthy eyes using Stratus optical coherence tomography. Arch Ophthalmol. 2006;124(2):193-8.
19. Paunescu LA, Schuman JS, Price LL, Stark PC, Beaton S, Ishikawa H, et al. Reproducibility of nerve fiber thickness, macular thickness, and optic nerve head measurements using Stratus OCT. Invest Ophthalmol Vis Sci. 2004; 45(6):1716-24.
20. Armstrong JD, Meyer D, Xu S, Elfervig JL. Long-term follow-up of Stargardt's disease and fundus flavimaculatus. Ophthalmology. 1998;105(3): 448-57;discussion 457-8.
21. Castro DDM, Castro CTM, Nakano K, Consoni Filho E, Ghidetti SM. Doença de Stargardt: descrição de 58 casos atendidos no Setor de Visão Subnormal da Escola Paulista de Medicina. Rev Bras Oftalmol. 1990;49(5):309-12.
Endereço para correspondência:
Otacílio de Oliveira Maia Júnior
Rua Adelmário Pinheiro, 10
Salvador (BA) CEP 41900-540
E-mail: [email protected]
Recebido para publicação em 13.07.2006
Última versão recebida em 03.04.2007
Aprovação em 31.05.2007
Nota Editorial: Depois de concluída a análise do artigo sob sigilo editorial e com a anuência do Dr. Arnaldo Furman Bordon sobre a divulgação de seu nome como revisor, agradecemos sua participação neste processo.
Trabalho desenvolvido no Departamento de Oftalmologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (USP) - São Paulo (SP) - Brasil.