

André Hamada1; Maria Rosa Bet de Moraes Silva2; Elisa Aparecida Gregório3
DOI: 10.1590/S0004-27492007000400017
RESUMO
OBJETIVO: Avaliar o epitélio ciliar interno (ECI) do corpo ciliar após aplicação de mitomicina C (MMC) sob retalho escleral, em animais tratados com dois tipos de inibidores da produção do humor aquoso. MÉTODOS: Foram estudados ambos os olhos de 16 coelhos divididos em 4 grupos experimentais. Foi realizado retalho escleral em todos os olhos dos animais, mas apenas os olhos direitos (OD) receberam MMC. No grupo 1 (G1) não houve tratamento prévio. Nos grupos G2 e G4 foi administrada acetazolamida e nos grupos G3 e G4 maleato de timolol. O ECI foi examinado à microscopia eletrônica de transmissão (MET). Os olhos esquerdos formaram os grupos controle. RESULTADOS: Em todos os grupos exceto no G1 OE, foram observadas: retração das células e/ou alargamento entre invaginações, mitocôndrias com rarefação, vesículas claras e corpos densos. A membrana limitante interna estava espessada, descontínua ou descolada em todos grupos exceto G1 OE e G2 OE. Foi observada liberação de material citoplasmático apenas nos grupos tratados com inibidores da produção de humor aquoso. CONCLUSÕES: 1- MMC, acetazolamida e maleato de timolol causaram alterações morfológicas no epitélio ciliar mesmo usados isoladamente. 2- A associação MMC e acetazolamida causou mais alterações do que a acetazolamida isoladamente, mas não mais do que a MMC isoladamente. 3- Nas demais associações as alterações foram semelhantes.
Descritores: Corpo ciliar; Corpo ciliar; Corpo ciliar; Corpo ciliar; Microscopia eletrônica de transmissão; Acetazolamida; Timolol; Coelhos
ABSTRACT
PURPOSE: To evaluate the effects of mitomycin C (MMC) on the internal ciliary epithelium (ICE) of the ciliary body of animals treated with two differents aqueous humor supressants. METHODS: The eyes of sixteen Norfolk albino rabbits divided into four experimental groups were studied. The right eyes (RE) of the four groups received 0.1 ml of MMC (0.5 mg/ml) under the scleral flap. The left eyes (LE) was the control group. Group 1 (G1) did not have any other treatment. To Group 2 (G2) and Group 4 (G4) acetazolamide was administered. To Group (G3) and Group 4 (G4) timolol maleate was administered. ICE was examined by transmission electron microscopy (TEM). RESULTS: The following aspects were observed in all groups, except in G1 LE: cell shrinkage and/or enlargement of intercellular spaces, rarefied mitochondria, clear vesicular structures and electron-dense bodies. The internal limitant membrane showed to be thickened, discontinued and separeted in all groups, except in G1 LE and G2 LE. Discharge of cytoplasmatic material was observed only in the groups treated with aqueous humor supressants. CONCLUSIONS: 1) MMC, acetazolamide and timolol maleate caused morphological alterations in the ciliary epithelium even when used alone. 2) The combination of MMC and acetazolamide caused more alterations than did isolated acetazolamide, but not more than MMC alone. 3) For the other combinations the alterations were similar.
Keywords: Ciliary body; Ciliary body; Epithelium; Epithelium; Microscopy, electron, transmission; Acetazolamide; Acetazolamide; Rabbits
INTRODUÇÃO
O glaucoma é apontado como a 2ª causa de cegueira no mundo(1) e é responsável por aproximadamente 8,5% das consultas de pacientes ao oftalmologista nos Estados Unidos da América(2). O número de pacientes portadores de glaucoma no mundo deverá crescer de 60,5 milhões para 79,6 milhões em 2020(1). No Brasil, há pelo menos 900.000 portadores de glaucoma, dos quais 720.000 são assintomáticos(3).
Apesar do tratamento clínico ser a primeira indicação para a maioria dos pacientes portadores de glaucoma, muitos pacientes necessitam de cirurgia para o controle da doença. A trabeculectomia tem sido a cirurgia mais utilizada para o tratamento cirúrgico do glaucoma. No entanto, seu sucesso é muito limitado em portadores de uveíte(4), pacientes submetidos à trabeculectomia prévia(5), glaucoma neovascular(6), glaucoma pós trauma(7), glaucoma congênito(8), infantil ou juvenil(9), glaucoma do afácico(10) e glaucoma pseudofácico(11). Para aumentar o sucesso das cirurgias anti-glaucomatosas, Chen em 1983(12) preconizou a utilização da mitomicina C (MMC) por seu efeito antiproliferativo. A partir desta data, a MMC foi e está sendo amplamente utilizada não só em trabeculectomias, mas também em outras cirurgias anti-glaucomatosas.
A utilização da MMC em cirurgias antiglaucomatosas pode no entanto, estar associada a várias complicações, como hipotonia(13-15), descolamento de coróide(16), endoftalmite(17), atalamia(18) e hemorragia retiniana(19).
A incidência de hipotonia em trabeculectomias com uso de MMC varia na literatura de 20% a 42%(13-14).
Entre as causas de hipotonia pós-trabeculectomia associadas à MMC, está a inibição excessiva da cicatrização, levando ao excesso de filtração e também à toxicidade ao epitélio ciliar(20).
Em 1985 foi descrita a "Síndrome da hipotonia e descolamento ciliocoroidal secundários à supressão farmacológica do humor aquoso após trabeculectomia" sem uso de MMC em pacientes que usaram previamente timolol e ou acetazolamida(21) que aponta a "sensibilização" prévia do epitélio ciliar por inibidores de produção do humor aquoso como causa desta hipotonia tardia pós trabeculectomia. Desta forma, pensamos que alterações morfológicas do epitélio ciliar causadas pela MMC, já descritas(20,22-25), poderiam se intensificar com esta "sensibilização" prévia por inibidores de produção do humor aquoso e potencialmente ser mais uma causa de hipotonia ou agravá-la.
Os objetivos deste trabalho foram:
1) Verificar as possíveis alterações no epitélio ciliar interno, após aplicação de MMC a 0,5 mg/ml sob retalho escleral em animais submetidos ao tratamento com dois tipos de inibidores da produção do humor aquoso;
2) Correlacionar as alterações encontradas no epitélio ciliar interno entre grupos submetidos ao tratamento com inibidores de produção do humor aquoso + MMC e apenas à MMC;
3) Comparar as alterações encontradas no epitélio ciliar interno entre os dois diferentes tipos de inibidores de produção do humor aquoso.
MÉTODOS
Foi realizado estudo experimental, randomizado, controlado e intervencionista, aprovado pela Comissão de Ética em Pesquisa Animal da Faculdade de Medicina de Botucatu - UNESP (Protocolo nº 262).
Foram utilizados 16 coelhos albinos, sadios, com peso médio de 3.594 kg, da raça Norfolk divididos em 4 grupos experimentais, os quais se diferenciaram pelo tratamento a que foram submetidos.
Grupo 1 (G1): Formado por 4 coelhos que tiveram o olho direito (OD) submetido à realização de retalho escleral e aplicação de 0,1 ml de MMC na concentração de 0,5 mg/ml e olho esquerdo (OE) submetido apenas ao retalho escleral.
Grupo 2 (G2): Formado por 4 coelhos que foram tratados com acetazolamida durante 2 meses - 1 mês antes e 1 mês depois da cirurgia (retalho escleral) e que tiveram o OD submetido à realização de retalho escleral e aplicação de 0,1 ml de MMC na concentração de 0,5 mg/ml e OE submetido apenas ao retalho escleral.
Grupo 3 (G3): Formado por 4 coelhos que foram tratados com maleato de timolol 0,5% colírio durante 2 meses - 1 mês antes e 1 mês depois da cirurgia (retalho escleral) e que tiveram o OD submetido à realização de retalho escleral e aplicação de 0,1 ml de MMC na concentração de 0,5 mg/ml e OE submetido apenas ao retalho escleral.
Grupo 4 (G4): Formado por 4 coelhos que foram tratados com acetazolamida e maleato de timolol 0,5% durante 2 meses - 1 mês antes e 1 mês depois da cirurgia (retalho escleral) e que tiveram o OD submetido à realização de retalho escleral e aplicação de 0,1 ml de MMC na concentração de 0,5 mg/ml e OE submetido apenas ao retalho escleral.
Os OE dos animais formaram os grupos controle.
Em cada grupo foi estudado o epitélio ciliar interno (voltado para a câmara anterior) à microscopia eletrônica de transmissão (MET), 30 dias após a cirurgia de retalho escleral.
Após sorteio e identificação, cada animal foi anestesiado com pentobarbital sódico a 4% na dose de 1 ml/kg injetado na veia marginal da orelha com agulha 25 x 7 (G22) e seringa de 10 ml. Também foi realizada anestesia tópica com colírio de tetracaína (colírio Anestésico® - Allergan), na dose de 1 gota, no fundo de saco imediatamente antes da cirurgia e quando havia reação do animal.
A cirurgia a que ambos os olhos de todos os animais foram submetidos, foi a de retalho escleral sem realização de procedimento filtrante. Após assepsia local com polivinil pirrolidona iodo em solução aquosa 10% e sob microscópio cirúrgico com aumento de 10 vezes, foi realizada fixação das pálpebras superior e inferior com fio de seda 4-0. Foi realizada retopexia do reto superior com seda 4-0 e o olho foi tracionado para baixo expondo a área cirúrgica entre o reto superior e o reto lateral. Realizou-se abertura conjuntivo-tenoniana de base fórnice e retalho escleral quadrado com 3 mm de lado, de meia espessura escleral delaminado com bisturi lâmina 15. Quando havia perfuração escleral o animal era excluído do experimento. Não foi utilizado cautério. Nos OD de todos os grupos foi colocado sob o retalho escleral por 5 minutos, um fragmento triangular de esponja de Weck® (Vistatek) medindo 15 mm de lado e 4 mm de base embebido em 0,1 ml de MMC na concentração de 0,5 mg/ml, seguido de irrigação com 20 ml de solução de cloreto de sódio a 0,9 mg/ml.
O retalho escleral e a conjuntiva foram reposicionados sem suturas.
Os animais dos grupos G3 e G4 receberam uma gota de colírio de Maleato de timolol® 0,5% (Allergan) de 12 em 12 horas durante 60 dias (30 dias antes da realização do retalho escleral e 30 dias depois).
Os animais dos grupos G2 e G4 receberam um comprimido de 45 mg de acetazolamida por dia durante 60 dias (30 dias antes da realização do retalho escleral e 30 dias após). O comprimido foi diluído em 5 ml de água destilada e introduzido pela orofaringe por meio de uma seringa descartável de 10 ml conectada a uma cânula plástica maleável com diâmetro de 1/2 polegada e com 15 cm de comprimento.
Foi feita observação clínica dos olhos sob microscópio cirúrgico nos: 1º, 7º, 15º e 30º dias pós-operatórios. Nenhum dos olhos apresentou alteração significativa.
Após o sacrifício do animal (30 dias após a cirurgia) com dose letal de pentobarbital sódico (2ml/kg) na veia marginal da orelha, os bulbos oculares foram enucleados, seccionados no equador e a metade anterior foi imersa em solução de glutaraldeido 2,5% em tampão fosfato (0,1 M - pH 7,3), por 2 dias. Após esse período, corpo ciliar e íris foram separados da esclera e foram recortados fragmentos da "pars plicata" de 1 x 1 mm, obtidos da região sob o retalho escleral. Os fragmentos foram processados para MET conforme padronização do Laboratório de Microscopia Eletrônica do Instituto de Biociências - UNESP - Botucatu.
Todos os espécimes foram documentados por meio de elétron-micrografias, utilizando-se filme Ektacrome Kodak e papel fotográfico Kodacrome RC Print F3 Kodak. A leitura das fotos foi feita por dois examinadores que não sabiam a que grupos os olhos pertenciam.
RESULTADOS
Grupo 1
OE controle (Figura 1)
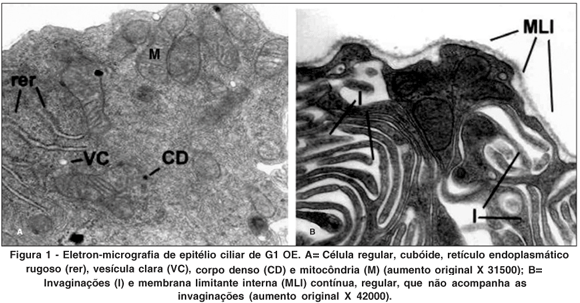
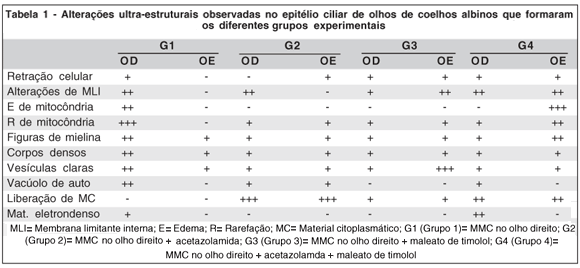
Os olhos esquerdos (OE) dos animais do G1 (submetidos apenas à realização do retalho escleral) apresentaram epitélio ciliar interno formado por camada única de células regulares e cubóides recoberta por membrana limitante interna contínua de espessura regular que não acompanhou as invaginações da membrana plasmática basal. A membrana plasmática nas faces laterais, apresentou numerosas invaginações imbricadas com as das células vizinhas. No citoplasma foi observado grande número de mitocôndrias alongadas ou arredondadas localizadas ao redor do núcleo e na parte basal da célula, próximas às invaginações. Foram observadas algumas mitocôndrias com figuras de mielina no seu interior. Ainda no citoplasma foram observados: retículo endoplasmático rugoso, retículo endoplasmático liso, complexos de Golgi, ribossomos livres. Vesículas claras, corpos densos e figuras de mielina também estavam presentes em pequena quantidade. O núcleo era arredondado, de contorno regular com discretas chanfraduras.
OD - MMC (Figura 2)
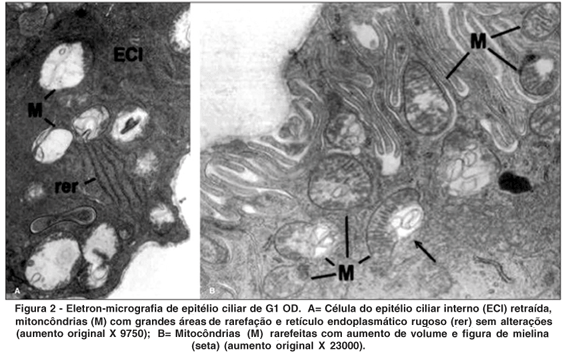
Os olhos direitos (OD) dos animais de G1 (submetidos à realização de retalho escleral e aplicação de MMC) apresentaram a membrana limitante interna com espessamento focal e ou descontinuidade. Foi também observado pequeno acúmulo de material eletrondenso de tamanho variado externo à membrana basal. Algumas células do epitélio ciliar interno apresentaram-se retraídas com diminuição das invaginações e outras com alargamento dos espaços intercelulares. As mitocôndrias mostraram grandes áreas de rarefação da matriz, aumento de volume, vacúolos de digestão e figuras de mielina (em maior quantidade que OE). Corpos densos e vesículas claras estavam presentes em maior quantidade do que no OE (controle).
Grupo 2
OE - Acetazolamida (Figura 3)
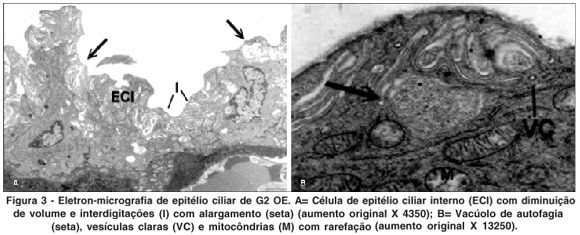
Nos olhos deste grupo observou-se diminuição do volume celular (retração) mas não foram observadas alterações da membrana limitante interna. No citoplasma foram observadas mitocôndrias com áreas de rarefação e figuras de mielina, porém mais preservadas do que as de OD de G1 (MMC).
Foram observados vacúolos de autofagia, vesículas claras, corpos densos e também liberação de material citoplasmático.
OD - Acetazolamida + MMC (Figura 4)
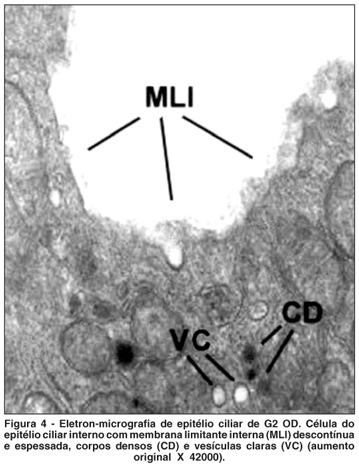
Nos olhos deste grupo a membrana limitante interna apresentou-se descontínua e/ou espessada, mas não foi observada retração celular. Havia alargamento entre as invaginações da membrana plasmática basal. As mitocôndrias apresentaram rarefação da matriz e figuras de mielina, semelhantes as de OE deste grupo. Também foram observadas vesículas claras, corpos densos e liberação de material citoplasmático.
Grupo 3
OE - Maleato do timolol (Figura 5)
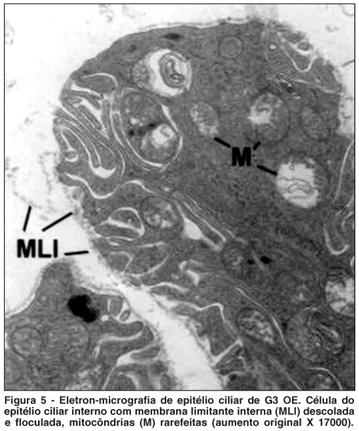
Nos olhos deste grupo observaram-se células com aspecto retraído e membrana limitante interna descolada e floculada. Foram observados também: alargamento e diminuição das invaginações, assim como figuras de mielina entre invaginações. As mitocôndrias apresentaram rarefação e figuras de mielina no seu interior.
No citoplasma observaram-se corpos densos e vesículas claras em grande quantidade. Foi observada liberação de material citoplasmático.
OD - Maleato de timolol + MMC (Figura 6)
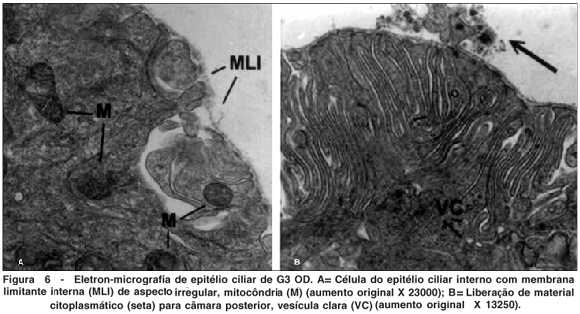
Foram observadas células de aspecto retraído e com diminuição das invaginações.
A membrana limitante interna estava descontínua e apresentava áreas de espessamento. As mitocôndrias apresentaram rarefação da matriz e figuras de mielina em seu interior (semelhante a OE).
Foi também observada liberação de material citoplasmático, vesículas claras e corpos densos.
Grupo 4
OE - Acetazolamida + Maleato de timolol (Figura 7)
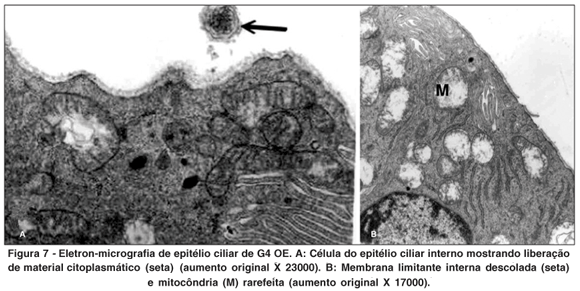
Neste grupo havia células com aspecto retraído. A membrana limitante interna apresentou-se irregular, isto é, com áreas mais densas alternadas com áreas mais rarefeitas e com descolamento de pedaços. A membrana plasmática basal apresentou diminuição das invaginações.
Grande quantidade de mitocôndrias apresentaram aspecto edemaciado, rarefação da matriz e figuras de mielina em seu interior. Foram ainda observados: corpos densos, vesículas claras e liberação de material citoplasmático.
OD - Acetazolamida + Maleato de timolol + MMC (Figura 8)
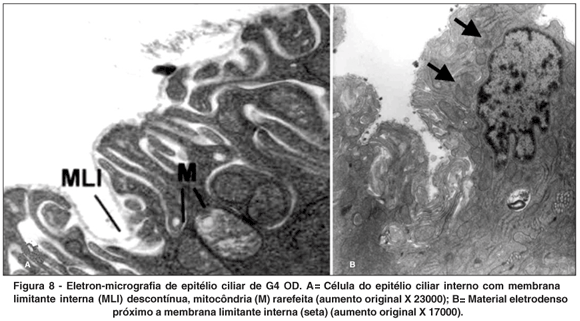
Neste grupo também havia retração e a membrana limitante interna mostrou-se descontínua e com acúmulo de material eletron-denso de vários tamanhos externo a ela. As invaginações da membrana plasmática basal apresentaram-se alargadas. As mitocôndrias apresentaram rarefação da matriz e figuras de mielina em seu interior.
No citoplasma foram observados corpos densos, vesículas claras e vacúolos de autofagia. Foi também observada liberação de material citoplasmático.
A tabela 1 apresenta um resumo das alterações ultra-estruturais observadas nos diferentes grupos experimentais.
DISCUSSÃO
A hipotonia pós-operatória prolongada tem sido freqüente complicação em cirurgias antiglaucomatosas associadas a utilização de MMC(13-15). No entanto, até o presente momento, as causas da hipotonia não estão bem esclarecidas. Uma das causas presumidas é o aumento da facilidade de saída do humor aquoso, já que foram observadas hipocelularidade subconjuntival e escleral em pacientes que apresentaram hipotonia persistente e que foram submetidos à revisão da bolha filtrante(23,26). No entanto, estudos com MET têm demonstrado efeito tóxico da MMC no epitélio ciliar de coelhos(20,22,24-25,27-31), ratos(32) e também em humanos(23). Sendo assim, uma das possíveis causas de hipotonia poderia ser a hipoprodução do humor aquoso, decorrente da toxicidade causada ao epitélio ciliar.
Foi demonstrado que o uso prévio de inibidores da produção do humor aquoso pode levar à "sensibilização" do epitélio ciliar, causando hipotonia em pacientes submetidos à trabeculectomia e foi dado o nome de "Síndrome da hipotonia secundária à supressão farmacológica do humor aquoso" a este quadro(21).
Assim utilizando tratamento prévio com os inibidores da produção do humor aquoso: acetazolamida e maleato de timolol, tentou-se verificar se a "sensibilização" causaria alterações morfológicas do epitélio ciliar interno que potencializassem as da MMC.
Apesar de o mecanismo íntimo de ação do maleato de timolol não estar até hoje totalmente esclarecido, a literatura aponta como seu principal mecanismo de ação a redução da produção do humor aquoso(33). Do ponto de vista morfológico foram descritas alterações do corpo ciliar de macacos Cynomolgus à MET, após tratamento com 180 microgramas de maleato de timolol por via tópica, com seguimento que variou de 2,7 a 7,4 meses, que incluíram: estreitamento de vasos estromais, espessamento da membrana basal do epitélio pigmentar, poucas invaginações basolaterais no epitélio pigmentado e não pigmentado, afinamento do epitélio não pigmentado com mitocondrias pequenas, grânulos pigmentados e fagolisossomos grandes(34).
A acetazolamida age reduzindo a produção do humor aquoso por meio da enzima anidrase carbônica(35). A presença da anidrase carbônica no epitélio ciliar de coelhos foi descrita em 1981, à microscopia eletrônica, tendo sido observada nas membranas celular lateral e apical do epitélio ciliar não pigmentado(36). No entanto não foram encontradas na literatura referências a estudos do epitélio ciliar à MET, após utilização da acetazolamida, que pudessem assim correlacionar a diminuição de produção do humor aquoso com alterações morfológicas.
No presente estudo, foi observada retração e/ou alargamento entre as invaginações das células do epitélio ciliar interno de todos os grupos, exceto do controle (OE de G1), devendo-se destacar no entanto que esta retração foi focal, não ocorrendo em todas as células, nem em todos os animais dos grupos.
Alterações do epitélio ciliar interno à MET pós uso de MMC já foram descritas previamente na literatura tanto em coelhos(20,22,24-25,27-28,30), ratos(32) quanto em humanos(23). Nos estudos realizados em animais, não houve tratamento prévio com nenhuma droga exceto o uso operatório da MMC. No caso humano, de uma paciente feminina de 78 anos, com glaucoma primário de ângulo aberto submetida à trabeculectomia com MMC que faleceu logo após a cirurgia, havia utilização prévia de maleato de timolol, além de outras drogas (pilocarpina e 5-fluorouracil)(23).
As alterações observadas à MET nos olhos submetidos à realização de retalho escleral e aplicação de MMC (G1-OD) incluíram: retração de células, irregularidades da membrana limitante interna, edema de mitocôndrias, vacúolos de autofagia, aumento de vesículas claras, alargamento dos espaços intercelulares, corpos de mielina e corpos densos. Estas alterações estão de acordo com alterações descritas anteriormente. Em coelhos chinchila pigmentados, aplicando MMC por via epiescleral durante 5 minutos em diferentes concentrações (0,05 mg/ml; 0,2 mg/ml e 1mg/ml), foram observaram à MET edema de mitocôndrias e vacúolos perinucleares(20). Neste trabalho os autores não descreveram, no entanto, alterações da membrana limitante interna e alargamento dos espaços intercelulares. Encontraram, além das alterações acima descritas, material eletron-denso próximo ao retículo endoplasmático rugoso. O trabalho, no entanto, não se refere à extensão das alterações e a número de animais que apresentaram alterações, que parece ser apenas um. Em coelhos não pigmentados (neozelandeses), foi descrito à MET do epitélio não pigmentado: marcada vacuolização, edema e rarefação de mitocôndrias e alargamento dos espaços intercelulares e alterações da membrana limitante interna(29). Utilizando MMC pela via subconjuntival também em coelhos não pigmentados (neozelandeses) outro estudo observou afinamento da membrana limitante interna, além de vacúolos e expansões dos espaços intercelulares mas não descreveu alterações de mitocôndrias(37). Ainda em coelhos, 28 dias após aplicação da MMC 0,4%, outros só encontraram edema mitocondrial e vacúolos no epitélio ciliar não pigmentado(28).
Os trabalhos da literatura acima referidos não comentam a presença de corpos mielínicos observados no grupo experimental (G1-OD) submetido à aplicação de MMC). Mas os mesmos foram descritos nas mitocôndrias de coelhos pigmentados com utilização de MMC 0,2 mg/ml por via epiescleral(24,38). A presença de corpos mielínicos não pode, no entanto, ser atribuída totalmente a ação da MMC, já que os olhos controle também os apresentaram em menor quantidade.
Os resultados do presente trabalho com a aplicação de MMC são, portanto, semelhantes aos descritos na literatura existente, exceto por algumas particularidades que provavelmente ocorreram por diferenças metodológicas nem sempre descritas nos trabalhos.
Os olhos do grupo G2, isto é, submetidos a tratamento prévio com acetazolamida durante 60 dias, apresentaram alterações que foram semelhantes entre os OD (com MMC) e OE sem (MMC), exceto quanto à irregularidade da membrana limitante interna que só ocorreu nos olhos submetidos também à MMC. Os achados comuns a olhos direitos e esquerdos deste grupo incluíram: alargamento das invaginações basais, rarefação da matriz mitocondrial, corpos mielínicos, vesículas claras, corpos densos, vacúolos de autofagia e liberação de material citoplasmático. Estas alterações comuns (a OD e OE de G2) foram semelhantes às observadas com o uso apenas da MMC (OD de G1), exceto a liberação de material citoplasmático. Desta forma, não só a MMC pode causar alterações morfológicas no epitélio ciliar, mas também o uso apenas de acetazolamida (OE de G2) que apresentou alterações semelhantes às causadas pela MMC isoladamente. Não foi encontrado na literatura nenhum estudo morfológico à MET do epitélio ciliar após utilização de acetazolamida em animais ou humanos.
Comparando-se, no entanto, as alterações de OD de G2 (acetazolamida e MMC) com OE de G2 (acetazolamida), nos OD havia mais alterações pois também apresentaram alterações da membrana limitante interna. Desta comparação pode-se deduzir que a MMC em olhos submetidos ao tratamento prévio com acetazolamida causa mais alterações morfológicas do que a acetazolamida sozinha. A observação de alterações morfológicas do epitélio ciliar interno em olhos de animais submetidos apenas ao tratamento prévio com acetazolamida, sugere que a "sensibilização", proposta em 1995(21) pode ser traduzida por estas alterações morfológicas.
Os olhos submetidos ao tratamento prévio com maleato de timolol tópico (G3), durante 60 dias, apresentaram alterações do epitélio ciliar interno nos OD (com MMC) que foram semelhantes às observadas nos OE (sem MMC). Estas alterações incluíram: células retraídas, membrana limitante interna irregular, diminuição e alargamento de invaginações, rarefação da matriz mitocondrial, figuras de mielina, vesículas claras, corpos densos, vacúolos de autofagia e liberação de material citoplasmático.
Portanto os resultados mostraram que também o maleato de timolol isoladamente foi capaz de levar a alterações morfológicas de epitélio ciliar interno de coelhos, alterações estas que poderiam ser a manifestação morfológica da "sensibilização" já descrita(21).
As alterações observadas nos olhos submetidos ao tratamento com maleato de timolol foram semelhantes às encontradas em macacos(34) e em cães(39).
No grupo 4, submetido ao tratamento com acetazolamida em associação com maleato de timolol por 60 dias foram observadas alterações do epitélio ciliar interno semelhantes nos OD (com MMC) e nos OE (sem MMC). As alterações foram semelhantes às dos demais grupos e incluíram: retração do epitélio ciliar interno, irregularidade da membrana limitante interna, alargamento das invaginações baso-laterais, edema e rarefação mitocondrial, corpos de mielina, corpos densos, vacúolos de autofagia e liberação de material citoplasmático.
A liberação de material citoplasmático observada nos OD e OE apenas nos grupos submetidos ao tratamento com acetazolamida e/ou maleato de timolol sugere que a mesma estaria relacionada à inibição da produção do humor aquoso.
As alterações observadas no epitélio ciliar interno dos diferentes grupos, exceto o G2, foram bastante semelhantes, ao contrário do que poderia se esperar com a "sensibilização" prévia com inibidores de produção do humor aquoso. Como possíveis explicações para este fato poderíamos apontar: o tempo de tratamento (60 dias), por se tratar de coelhos jovens e saudáveis ou porque as alterações mais intensas ocorreram em outras partes do corpo ciliar, não avaliadas no presente estudo, como vasos e nervos.
Também deve ser lembrado que as alterações morfológicas observadas no epitélio ciliar observadas com utilização de MMC e inibidores de produção do humor aquoso não significam necessariamente hipotonia e mais estudos se fazem necessários para elucidar esta associação.
CONCLUSÕES
1) A MMC, a acetazolamida e o maleato de timolol causaram alterações morfológicas do epitélio ciliar mesmo usados isoladamente.
2) A associação MMC e acetazolamida causou mais alterações ao epitélio ciliar interno do que a acetazolamida isoladamente, mas não mais do que a MMC isoladamente.
3) A associação MMC e maleato de timolol não causou mais alterações do que MMC e o maleato de timolol isoladamente.
4) A associação MMC, acetazolamida e maleato de timolol não causou mais alterações do que com as drogas usadas isoladamente.
REFERÊNCIAS
1. Quigley HA, Broman AT. The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol. 2006;90(3):262-7.
2. Muther TF, Friedland BR. Autoradiographic localization of carbonic anhydrase in the rabbit ciliary body. J Histochem Cytochem. 1980;28(10):1119-24.
3. Mello PAA, Mandia Júnior C, organizadores. In: 2º Consenso Brasileiro de glaucoma primário de ângulo aberto. São Paulo: Sociedade Brasileira de Glaucoma; 2005. p. 4-44.
4. Ceballos EM, Beck AD, Lynn MJ. Trabeculectomy with antiproliferative agents in uveitic glaucoma. J Glaucoma. 2002;11(3):189-96.
5. Andreanos D, Georgopoulos GT, Vergados J, Papaconstantinou D, Liokis N, Theodossiadis P. Clinical evaluation of the effect of mitomycin-C in re-operation for primary open angle glaucoma. Eur J Ophthalmol. 1997;7(1): 49-54.
6. Hyung SM, Kim SK. Mid-term effects of trabeculectomy with mitomycin C in neovascular glaucoma patients. Korean J Ophthalmol. 2001;15(2):98-106.
7. Manners T, Salmon JF, Barron A, Willies C, Murray AD. Trabeculectomy with mitomycin C in the treatment of post-traumatic angle recession glaucoma. Br J Ophthalmol. 2001;85(2):159-63.
8. Beck AD, Freedman S, Kammer J, Jin J. Aqueous shunt devices compared with trabeculectomy with Mitomycin-C for children in the first two years of life. Am J Ophthalmol. 2003;136(6):994-1000.
9. Tsai JC, Chang HW, Kao CN, Lai IC, Teng MC. Trabeculectomy with mitomycin C versus trabeculectomy alone for juvenile primary open-angle glaucoma. Ophthalmologica. 2003;217(1):24-30.
10. Rodriguez-Bermejo Guijó C. [Trabeculectomy with mitomycin C in aphakic glaucoma]. Arch Soc Esp Oftalmol. 2000;75(1):8-9. Spanish.
11. Shingleton BJ, Alfano C, O'Donoghue MW, Rivera J. Efficacy of glaucoma filtration surgery in pesudophakic patients with or without conjunctival scarring. J Cataract Refract Surg. 2004;30(12):2504-9.
12. Chen CW. Enhanced intraocular pressure controlling effectiveness of trabeculectomy by local application of mitomycin C. Trans Asia-Pacific Acad Ophthalmol. 1983;9:172-7.
13. Bindlish R, Condon GP, Schlosser JD, D'Antonio J, Lauer KB, Lehrer R. Efficacy and safety of mitomycin-C in primary trabeculectomy: five-year follow-up. Ophthalmology. 2002;109(7):1336-41; discussion 1341-2.
14. Kobayashi H, Kobayashi K, Okinami S. A comparison of the intraocular pressure-lowering effect and safety of viscocanalostomy and trabeculectomy with mitomycin C in bilateral open-angle glaucoma. Graefes Arch Clin Exp Ophthalmol. 2003;241(5):359-66.
15. Jacobi PC, Dietlein TS, Krieglstein GK. Adjunctive mitomycin C in primary trabeculectomy in young adults: a long-term study of case-matched young patients. Graefes Arch Clin Exp Ophthalmol. 1998;236(9):652-7.
16. Mietz H, Jacobi PC, Krieglstein GK. Postoperative application of mitomycin for trabeculectomies. Arch Ophthalmol. 2000;118(10):1341-8.
17. Solomon A, Ticho U, Frucht-Pery J. Late-onset, bleb-associated endophthalmitis following glaucoma filtering surgery with or without antifibrotic agents. J Ocul Pharmacol Ther. 1999;15(4):283-93.
18. Hamard P, Tazartes M, Ayed T, Quesnot S, Hamard H. [Prognostic outcome of leaking filtering blebs reconstruction with rotational conjunctival flaps]. J Fr Ophtalmol. 2001;24(5):482-90. French.
19. Suzuki R, Nakayama M, Satoh N. Three types of retinal bleeding as a complication of hypotony after trabeculectomy. Ophthalmologica. 1999; 213 (2):135-8.
20. Mietz H, Addicks K, Diestelhorst M, Krieglstein GK. Extraocular application of mitomycin-C in a rabbit model: cytotoxic effects on the ciliary body and epithelium. Ophthalmic Surg. 1994;25(4):240-4.
21. Vela MA, Campbell DG. Hypotony and ciliochoroidal detachment following pharmacologic aqueous suppressant therapy in previously filtered patients. Ophthalmology. 1985;92(1):50-7.
22. Mietz H, Addicks K, Bloch W, Krieglstein GK. Long-term intraocular toxic effects of topical mitomycin C in rabbits. J Glaucoma. 1996;5(5):325-33.
23. Nuyts RM, Felten PC, Pels E, Langerhorst CT, Geijssen HC, Grossniklaus HE, Greve EL. Histopathologic effects of mitomycin C after trabeculectomy in human glaucomatous eyes with persistent hypotony. Am J Ophthalmol. 1994;118(2):225-37.
24. Schraermeyer U, Diestelhorst M, Bieker A, Theisohn M, Mietz H, Ustundag C, et al. Morphologic proof of the toxicity of mitomycin C on the ciliary body in relation to different application methods. Graefes Arch Clin Exp Ophthalmol. 1999;237(7):593-600.
25. Moraes-Silva MRB, Gregório EA. Efeito da mitomicina C no epitélio ciliar. Estudo experimental em coelhos com microscopia eletrônica de varredura e de transmissão. Rev Bras Oftalmol. 2006;65(1):18-27.
26. Hutchinson AK, Grossniklaus HE, Brown RH, McManus PE, Bradley CK. Clinicophatologic features of excised mitomycin filtering blebs. Arch Ophthalmol. 1994;112(1):74-9.
27. Akyol N, Demir T, Cobanoglu B, Ulas F. Ciliary body toxicity of cyclosporin A and octreotide acetate in rabbit eyes: a comparison with mitomycin C and 5-fluorouracil. Graefes Arch Clin Exp Ophthalmol. 2003;241(10):816-22.
28. Hara T, Obata H, Shirato S, Araie M. [The cytotoxic effect of topical mitomycin C on the ciliary body in rabbits]. Nippon Ganka Gakkai Zasshi. 1998;102(2):88-94. Japanese.
29. Teague BJ, Skuta GL, Mardelli PG, Shaver RP, Nordquist RE. Ciliary body and retinal toxicity after subconjunctival injection of mitomycin C in rabbit eyes [abstract]. Invest Ophthalmol Vis Sci. 1995;36:S90.
30. Xia X, Jiang Y, Huang P, Wu Z, Zeng Q, Wen J. [Cytotoxic effect of mitomycin C on the nonpigmented epithelium of ciliary body in rabbit eyes]. Zhonghua Yan Ke Za Zhi. 1998;34(3):190-3, 12. Chinese.
31. Sari A, Onol M, Ozdek S, Ozogul C, Hasanreisoglu B. Effect of mitomycin C on ciliary body and intraocular pressure with various application depths: an experimental study. Clin Experiment Ophthalmol. 2005;33(2):169-75.
32. Levy J, Tessler Z, Rosenthal G, Klemperer I, Zirkin HJ, Kachko L, Lifshitz T. Toxic effects of subconjunctival 5-fluorouracil and mitomycin C on ciliary body of rats. Int Ophthalmol. 2001;24(4):199-203.
33. Neufeld AH. Experimental studies on the mechanism of action of timolol. Surv Ophthalmol. 1979;23(6):363-70.
34. Lütjen-Drecoll E, Kaufman PL, Eichhorn M. Long-term timolol and epinephrine in monkeys. I. Functional morphology of the ciliary processes. Trans Ophthalmol Soc U K. 1986;105(Pt 2):180-95.
35. Helbig H, Korbmacher C, Erb C, Nawrath M, Knuuttila KG, Wistrand P, Wiederholt M. [Carbonic anhydrase and its function in ion transport in cultivated pigmented ciliary body epithelial cells]. Fortschr Ophthalmol. 1989;86(5):474-7. German.
36. Lütjen-Drecoll E, Lönnerholm G. Carbonic anhydrase distribution in the rabbit eye by light and electron microscopy. Invest Ophthalmol Vis Sci. 1981;21(6):782-97.
37. Heaps RS, Nordlund JR, Gonzalez-Fernandez F, Redick JA, Conway BP. Ultrastructural changes in rabbit ciliary body after extraocular mitomycin C. Invest Ophthalmol Vis Sci. 1998;39(10):1971-5.
38. Bieker A, Diestelhorst M, Schaermeyer U, Theisohn M, Mietz H, Josef G, et al. Morphologic proof of toxicity of mitomycin C on the ciliary body in relation with different application methods [abstract]. Invest Ophthalmol Vis Sci. 1997;38:S553.
39. Moraes-Silva MRB, Macedo AR, Gregório EA, Schellini SA. Effect of 0,5% timolol maleate on the ciliary epithelium of the dog [abstract]. Invest Ophthalmol Vis Sci. 1996;37:S1103.
Endereço para correspondência:
Maria Rosa Bet de Moraes Silva
Faculdade de Medicina de Botucatu - UNESP - Departamento OFT/ORL/CCP
Distrito de Rubião Júnior s/nº
Botucatu (SP) - CEP 18618-970
E-mail: [email protected]
Recebido para publicação em 31.10.2006
Última versão recebida em 09.03.2007
Aprovação em 02.04.2007
Trabalho realizado na Faculdade de Medicina de Botucatu e no Instituto de Biociências da Universidade Estadual Paulista "Julio Mesquita Filho" - UNESP - Botucatu (SP) - Brasil.