

Manuel Neuzimar Pinheiro Jr.1; Procópio Miguel dos Santos2; Regina Cândido Ribeiro dos Santos4; Jeison de Nadai Barros6; Luiz Fernando Passos7; José Cardoso Neto9
DOI: 10.1590/S0004-27492007000400016
RESUMO
OBJETIVO: Avaliar se a utilização por via oral do óleo de linhaça (Linum usitatissimum), que diminui a inflamação na artrite reumatóide, pode auxiliar no tratamento da ceratoconjuntivite seca de portadores da síndrome de Sjögren. MÉTODOS: Em estudo clínico randomizado, 38 pacientes do sexo feminino, com diagnóstico de artrite reumatóide ou lúpus eritematoso sistêmico associadas à ceratoconjuntivite seca e síndrome de Sjögren, provenientes do ambulatório de Reumatologia do Hospital Universitário da Universidade Federal do Amazonas, foram consecutivamente selecionadas. O diagnóstico de ceratoconjuntivite seca foi baseado em questionário para olho seco (Ocular Surface Disease Index - OSDI®), Teste I de Schirmer, tempo de quebra do filme lacrimal com fluoresceína e instilação do corante rosa bengala a 1%, com intensidade da impregnação da superfíce ocular quantificada pela escala de van Bijsterveld. Todas as pacientes tiveram a inflamação da superfície conjuntival avaliada e quantificada por interpretação de exame de citologia de impressão conjuntival antes do início e ao final do estudo. As pacientes foram divididas em três grupos: Grupo I (n=13), Grupo II (n=12) e Grupo III (n=13). O Grupo I recebeu cápsulas com dose final de 1 g/dia de óleo de linhaça, o Grupo II recebeu cápsulas com dose final de 2 g/dia de óleo de linhaça e o Grupo III - controle - recebeu cápsulas com placebo, por 180 dias. RESULTADOS: Comparando os resultados no início e no final do tratamento, foram verificadas mudanças estatisticamente significantes (p<0,05) nos sintomas medidos pelo OSDI®, na inflamação da superfície ocular quantificada pela citologia de impressão conjuntival e nos testes I de Schirmer e tempo de quebra do filme lacrimal com fluoresceína nos Grupos I e II, quando comparados ao Grupo-controle. CONCLUSÃO: Terapia oral com óleo de linhaça, em cápsulas na dose de 1 ou 2 g/dia, reduz a inflamação da superfície ocular e melhora os sintomas de olho seco em pacientes portadores da síndrome de Sjögren. Estudos de longo prazo são necessários para confirmar o papel desta terapia como auxiliar no tratamento da ceratoconjuntivite seca de portadores da síndrome de Sjögren.
Descritores: Síndromes do olho seco; Ceratoconjuntivte seca; Óleo de semente do linho; Ceratite; Síndrome de Sjögren; Lágrimas
ABSTRACT
PURPOSE: To evaluate if oral flaxseed oil (Linum usitatissimum), which reduces the inflammation in rheumatoid arthritis, may help keratoconjunctivitis sicca's treatment in Sjögren's syndrome patients. METHODS: In a randomized clinical trial, 38 female patients with rheumatoid arthritis or systemic lupus erithematosus associated with keratoconjunctivitis sicca and Sjögren's syndrome were consecutively selected from patients of the Departament of Reumatology of the Amazonas University Hospital. Keratoconjunctivitis sicca diagnosis was based on a dry-eye symptom survey score (Ocular Surface Disease Index - OSDI®), Schirmer-I test, fluorescein break-up time, 1% Rose Bengal staining of ocular surface measured by the van Bijsterveld scale. All patients had ocular surface inflammation evaluated and quantified by conjunctival impression cytology, before and after the study. The subjects were divided into three groups with 13 (Group I), 12 (Group II) and 13 (Group III) patients. Group I received flaxseed oil capsules with a final 1 g/day dosis, Group II flaxseed oil capsules with a final 2 g/day dosis and Group III - controls - placebo, for 180 days. RESULTS: Comparing the results at the beginning and at the end of the treatment, statistically significant changes (p<0.05) in symptoms (OSDI®), ocular surface inflammation quantified by conjunctival impression cytology, Schirmer-I test and fluorescein break-up time occurred in Groups I e II when compared to controls. CONCLUSIONS: Therapy with oral flaxseed oil capsules 1 or 2 g/day reduces ocular surface inflammation and ameliorates the symptoms of keratoconjunctivitis sicca in Sjögren's syndrome patients. Long-term studies are needed to confirm the role of this therapy for keratoconjunctivitis sicca in Sjögren's syndrome.
Keywords: Dry eye syndromes; Keratoconjunctivitis sicca; Flaxseed oil; Keratitis; Sjögren's syndrome; Tears
INTRODUÇÃO
O quadro caracterizado como "síndrome do olho seco", ceratoconjuntivite seca (CCS) ou simplesmente olho seco (OS), uma das doenças mais comuns da prática oftalmológica(1), se associado ao ressecamento oral por deficiência das glândulas produtoras de saliva e a alterações de cunho reumatológico, caracteriza a "síndrome de Sjögren" (SS)(2), cujo risco de manifestação de OS é maior em mulheres e idosos(3-4).
O diagnóstico é eminentemente clínico com a anamnese, o exame ocular e o exame físico dirigidos para a suspeita de OS(1,4). A ajuda de exames específicos utilizados como testes diagnósticos para olho seco (TDOS), é essencial(2) e, entre eles, destacam-se: 1) Teste de Schirmer I (SCH1)(5); 2) Tempo de quebra do filme lacrimal (BUT)(6); 3) Coloração com o colírio rosa bengala 1%, com quantificação da intensidade das alterações (RBVB)(7).
O uso dos ácidos graxos essenciais (AGE) em apresentação oral, na forma de óleo de linhaça ou óleo de peixe, é considerado uma alternativa para o tratamento de portadores de diversas formas de deficiência lacrimal, embora este fato não encontre muito respaldo baseado em evidências na literatura(8). A dose ideal não foi bem determinada e admite-se que sua eficácia pode variar(9-10). São fontes de ácidos graxos essenciais do tipo ômega 3: as nozes, os peixes de água fria (salmão, atum, bacalhau), a semente de soja, o óleo de canola e o óleo de linhaça (OL)(8-11).
Já foi demonstrado que o uso sistêmico do ácido linolêico (AL) e do g-linolêico (AGL), reduz a inflamação ocular e melhora os sintomas de OS por deficiência aquosa(10). O baixo índice de ácidos graxos na dieta ocidental em comparação com a oriental, assinala a possibilidade da prevenção de doenças que estariam ligadas à produção de tecido inflamatório, como o OS, por meio da suplementação de alimentos, tais como: óleo de semente de linhaça, nozes e vegetais foliáceos, muito presentes na dieta oriental(11). O maior consumo de AGE tipo ômega 3 (n-3) está associado a uma menor incidência de OS em mulheres(12). Os AGE contêm compostos antiinflamatórios naturais, com a propriedade de aliviar sintomas da artrite e de outras doenças auto-imunes(13).
Trabalhos clínicos em humanos e experimentais em animais descrevem o uso oral do óleo de linhaça (Linum usitatissimum) com potencial benéfico em diversas áreas da medicina(14-17), visto que ele possui os ácidos graxos ômega 6 e ômega 3 em proporção considerada ideal(14,17).
O objetivo do presente estudo é avaliar a eficácia da utilização por via oral do óleo de linhaça no tratamento da CCS de portadores de SS secundária à artrite reumatóide (AR) ou ao lúpus eritematoso sistêmico (LES).
MÉTODOS
Em estudo prospectivo clínico randomizado duplo cego, amostra de pacientes provenientes do Ambulatório de Reumatologia da Universidade Federal do Amazonas (UFAM), com diagnóstico sorológico confirmado de AR ou LES(18), foi triada, após resposta a questionário adaptado(19) por apresentarem sinais e sintomas compatíveis com de SS (irritação ocular e boca seca). Após a triagem inicial, foi feita avaliação oftamológica completa, acrescida de TDOS selecionados (BUT, SCH1, RBVB). Os critérios de inclusão no estudo foram: tempo de quebra do filme lacrimal < a 8 segundos, teste de Schirmer tipo I (realizado sem a instilação de colírio anestésico ou qualquer outro, colocou-se as tiras de papel filtro para o teste de Schirmer I Color Bar Schirmer Tear Test®, Eagle Vision, Memphis, EUA, com uma das extremidades na altura de 5mm dobrada e inserida no fundo de saco conjuntival, permanecendo 5 minutos em contato com a conjuntiva, retira-se o papel e após um minuto é medida a extensão úmida a partir da dobra) <8 mm, escala de van Bjisterveld(7) com pontuação entre 3 a 7. Foram selecionadas 38 pacientes do sexo feminino, distribuidas em três grupos (13 para o Grupo 1, 12 para o Grupo 2 e 13 para o Grupo 3), com idade entre 21 e 55 anos, portadoras de OS e SS secundária(20). O nível da inflamação da superfície ocular (21) e a distribuição entre os grupos de portadoras de AR ou LES foi similar. O Grupo 1, foi submetido a tratamento com uma cápsula (com 1 g) de OL (Douglas Laboratories®, Pittsburgh, PA, EUA, importadas pela "Langfor Importação e Distribuição", São Paulo, SP, Brasil) e uma cápsula de placebo (950 mg de óleo mineral sintético, 50 mg de óleo de prímula), idêntica à do OL. O Grupo 2 foi medicado com duas cápsulas de OL. O Grupo 3, com duas cápsulas de placebo. A duração do tratamento foi de 180 dias. Após a seleção, as pacientes foram orientadas a responder a outro questionário - Ocular Surface Disease Index (OSDI®)(22) e submetidas ao exame de citologia de impressão conujtival (CI). Os TDOS selecionados (BUT e SCH1), a resposta ao questionário OSDI® e a CI foram realizados nos dias 0 e 180.
Citologia de impressão conjuntival
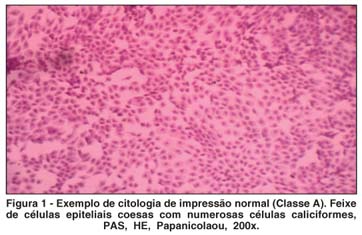
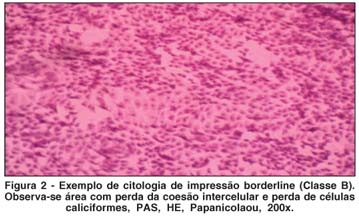
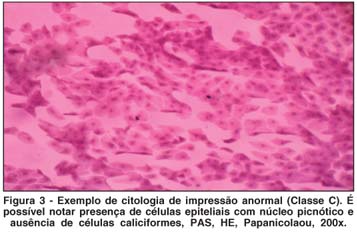
A CI foi realizada a partir da coleta de material da superfície ocular, após instilação de colírio anestésico, utilizando papel de filtro padronizado (Millipore Biopore Membrane®, código HAWP304FO, Millipore Corporation, Billerica, MA, EUA), que posteriormente foi fixado e submetido a uma técnica de coloração padronizada(23-24). A leitura das lâminas de CI deste estudo foi realizada e documentada sempre pelo mesmo observador (JNB), do Laboratório de Doenças Externas Oculares, da Universidade Federal de São Paulo, utilizando microscópio óptico (DMLB, Leica®, Solms, Alemanha). Os parâmetros avaliados foram: presença de células polimorfonucleadas (PMN), junções intercelulares, presença de mucina, quantidade de células caliciformes e relação núcleo-citoplasma. As amostras foram classificadas conforme escala padronizada modificada(23-25), que atribui pontos de 0 a 2 para sete itens diferentes (celularidade, contato célula-célula, relação núcleo/citoplasma, cromatina nuclear, distribuição de células caliciformes, queratinização e células inflamatórias). Quanto maior a pontuação, mais avançado o quadro inflamatório. Considerou-se classe A, quando presentes de 0 a 3 pontos, classe B, de 4 a 6 e classe C, mais de 6 pontos. Os exames foram feitos no olho direito (OD), com a coleta realizada na conjuntiva superior (OD sup) e temporal (OD temp).
RESULTADOS
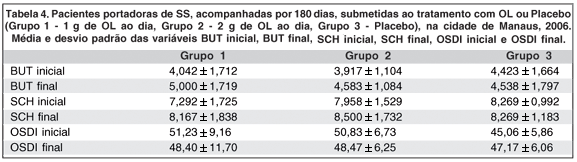
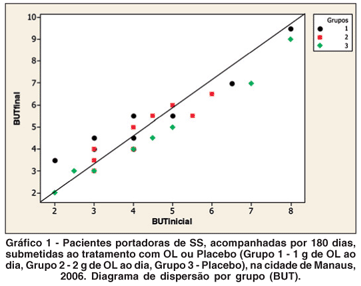
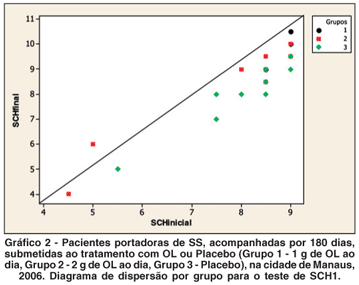
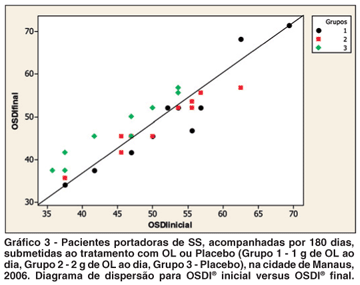
Para comparar o comportamento dos grupos com relação ao BUT, ao SCH1 e ao questionário OSDI®, foi realizada análise de covariância (ANCOVA). Para o BUT e o SCH1, foi utilizada a média dos valores observados para cada olho. Como variável resposta, foi utilizada a medida observada ao final do tratamento. Como variável regressora, foi utilizada a medida observada antes do início do tratamento. A variável grupo foi considerada como um fator, com três níveis: Grupo 1 - óleo de linhaça 1 g; Grupo 2 - óleo de linhaça 2 g; e Grupo 3 - placebo. Os valores dos TDOS, BUT e SCH1 apresentaram aumento estatisticamente significante ao final do tratamento (Tabelas 1, 2 e 4; Gráficos 1 e 2) quando comparados os grupos tratados (1 e 2) com o grupo não tratado. Os valores do questionário OSDI® apresentaram diminuição estatisticamente significante ao final do tratamento (Tabelas 3 e 4; Gráfico 3), quando comparados os grupos tratados (1 e 2) com o grupo não tratado (3).



Para a citologia de impressão conjuntival, os resultados foram organizados em classes e os grupos comparados por meio de testes para proporção.
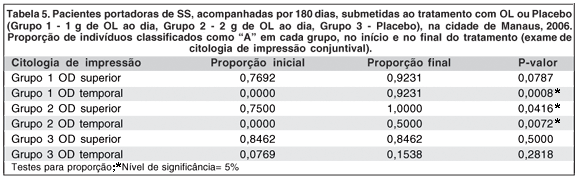
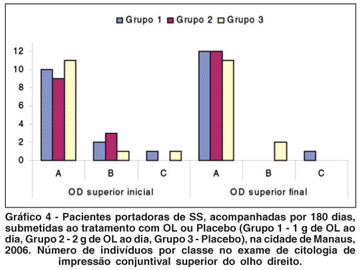
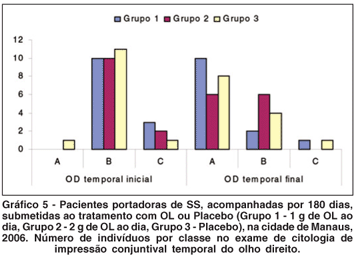
A comparação entre a proporção de indivíduos classificados como "A" em cada grupo, no início e ao final do tratamento, revelou aumento estatisticamente significante, nos exames do Grupo 1 (OL 1 g), coletados no olho direito, (quadrante temporal), e do Grupo 2 (OL 2 g), coletados no olho direito (quadrantes superior e temporal). Não houve evolução para o Grupo 3 (não tratado). Na região interpalpebral exposta (região temporal), a melhora das características citológicas estudadas após o tratamento com OL, foi ainda mais significativa (Figuras 1 a 3; Tabela 5; Gráficos 4 e 5).
DISCUSSÃO
A melhora dos sintomas e das condições da superfície ocular constitui um difícil objetivo a ser alcançado em portadores de OS(1). O uso do OL oral como auxiliar no tratamento de portadores de OS é baseado na sua eficácia na AR, doença inflamatória crônica e auto-imune, caracterizada por poliartrite simétrica(26). Portadores de OS têm processo inflamatório que afeta a superfície ocular e as glândulas lacrimais, influenciado por citoquinas mediadas por receptores(27). A capacidade de esteróides e de agentes imunomoduladores de melhorar quadros de OS moderados a severos dá suporte à hipótese que um importante processo inflamatório contribui decisivamente para o ciclo vicioso de sinais e sintomas que estão presentes nesses pacientes(28-29). A eficácia do OL como auxiliar no tratamento de OS, pode ser explicada pela elevação local das prostaglandinas tipo 1 (PGE 1), já demonstrada após ingestão sistêmica de AL e AGL, que estão entre os componentes do OL com comprovado e significativo aumento de PGE 1 no filme lacrimal(30).
O presente estudo avaliou de forma subjetiva os sintomas e de forma objetiva os sinais da superfície ocular de portadores de OS, associado à SS, para tentar avaliar o papel do OL no tratamento do quadro ocular desses indivíduos. A citologia de impressão conjuntival foi utilizada no presente estudo para comprovar de forma objetiva a melhora do quadro inflamatório da superfície ocular. A detecção do HLA-DR em células epiteliais da superfície ocular já foi demonstrada, com aumento significativo deste marcador inflamatório em olhos de portadores de OS, quando comparado a indivíduos normais(31) e, ainda, importante correlação com a severidade do quadro de OS(32).
No presente estudo, houve um aumento significante dos valores médios do teste de BUT para todos os indivíduos tratados com OL, independente da dose utilizada (Tabelas 1 e 4; Gráfico 1). Em trabalho similar(10), ao final do estudo, não foi encontrada melhora significativa do BUT e do SCH1 em pacientes portadores de OS, com diagnóstico confirmado por estes testes, e pela lizamina verde, acompanhados por 45 dias e subdivididos em três grupos, antes e após o consumo de AGE (28,5 g de ácido linolêico e 15 mg de ácido gama-linolêico).
Com relação ao teste SCH1, também ocorreu no presente estudo um aumento significante dos valores médios ao final do tratamento para os dois grupos tratatos com OL (Tabelas 2 e 4; Gráfico 2). Já foi demonstrado efeito positivo nos sintomas de ressecamento oral, nos achados de placas dentárias, no sangramento gengival e na análise microbiológica de secreção bucal, em pacientes portadores de SS avaliados por meio de questionário adaptado, após uso local por três semanas de solução contendo extrato de OL, provavelmente relacionado à diminuição da inflamação local, com melhora estatisticamente significativa dos sintomas nos dois grupos estudados (solução oral com OL somente, e solução oral associada de OL e clorexidina)(33).
Analisando o questionário OSDI®, observa-se que nos dois grupos tratados com OL, ocorreu diminuição significante dos seus valores médios ao final do tratamento (Tabelas 3 e 4; Gráfico 3). Em estudo semelhante(10) foi verificada melhora estatisticamente significante dos sintomas desse quadro eminentemente inflamatório, com base nos índices de questionário adaptado, após tratamento oral com AGE. Outros estudos também relacionaram a ingesta de AGE com a diminuição de sintomas e sinais inflamatórios em voluntários portadores de artrite reumatóide(34).
Com relação à CI, os indivíduos foram subdivididos em classes "A", "B" ou "C", de acordo com a pontuação obtida nos exames da conjuntiva superior e temporal, no início e no final do tratamento (classe "A" significando menor quantidade de sinais inflamatórios). A proporção de indivíduos que foram relacionados como classe "A" no exame de citologia de impressão conjuntival, no início e no final do tratamento em cada grupo, serviu como base para a comparação entre os grupos (Gráficos 4 e 5; Figuras 1 a 3). Houve melhora estatisticamente significante na proporção de indivíduos classificados como classe "A", ao final do tratamento, para o Grupo 1 (OL 1 g/dia), no exame de citologia de impressão conjuntival do olho direito temporal e para o Grupo 2 (OL 2 g/dia), no exame de citologia de impressão conjuntival do olho direito superior e temporal, o que não ocorreu no grupo controle (Tabela 5). Este achado comprova de forma objetiva a melhora da inflamação da superfície ocular de portadores de OS, associado à SS, após a ingesta de OL durante 180 dias, quando comparados com grupo não tratado. Outros trabalhos já confirmaram melhora significativa da inflamação da superfície ocular em grupos tratados com AGE, quando comparados a grupo tratado somente com placebo e lágrimas artificiais, baseada na expressão do antígeno de histocompatibilidade classe II, HLA-DR, avaliado por exame histopatológico de amostras da conjuntiva bulbar(10). O controle da inflamação, após consumo de óleo de linhaça e óleo de peixe, também foi demonstrado por estudos com voluntários saudáveis e com portadores de artrite reumatóide, nos quais se comprovou diminuição da produção de intermediadores do processo inflamatório (citoquinas, fator de necrose tumoral alfa e interleucina-1 beta) após dieta suplementar com estes AGE(34).
Fator comum a todos os processos patológicos da superfície ocular no quadro de OS, é a subjacente inflamação com a possível melhora das condições da superfície ocular associada à correta abordagem do processo inflamatório(35).
Este estudo demonstrou o potencial do OL oral no tratamento de portadores de OS inflamatório, associado à SS, com melhora dos sintomas e da condição das células epiteliais da conjuntiva, além de redução significativa da inflamação da superfície ocular como demonstrado pelo exame de CI. Não foi observada neste estudo diferença significante entre os resultados dos grupos tratados com 1 g ou 2 g de OL. Faz-se necessário o prosseguimento de pesquisas que visem acessar dados relativos a dosagens do OL, comparações entre AGE de origem animal (óleo de peixe) e vegetal (óleo de linhaça), em grupos maiores de pacientes e com seguimento mais prolongado, para confirmar o papel desta terapia para portadores de OS/CCS, associado ou não à SS.
CONCLUSÃO
O uso oral do OL em cápsulas, na dose de 1 g ou 2 g ao dia, durante 180 dias, mostrou-se capaz não só de melhorar os índices dos TDOS selecionados (BUT e SCH1) e a resposta ao questionário OSDI®, que avalia a gravidade do quadro de OS, mas também de diminuir a inflamação da superfície ocular medida pela CI em portadoras de OS associado à SS.
Este estudo demonstrou o potencial do OL oral no tratamento de portadores de OS inflamatório, associado à SS, com melhora dos sintomas e da condição das células epiteliais da conjuntiva, além de redução significativa da inflamação da superfície ocular como demonstrado pelo exame de CI. Não foi observada neste estudo diferença significante entre os resultados dos grupos tratados com 1 g ou 2 g de OL. Faz-se necessário o prosseguimento de pesquisas que visem acessar dados relativos a dosagens do OL, comparações entre AGE de origem animal (óleo de peixe) e vegetal (óleo de linhaça), em grupos maiores de pacientes e com seguimento mais prolongado, para confirmar o papel desta terapia para portadores de OS/CCS, associado ou não à SS.
REFERÊNCIAS
1. Nishiwaki-Dantas MC. Atualização em olho seco. Arq Bras Oftalmol. 1999; 62(1):101-5.
2. Daniels TE. Sjögren's syndrome: clinical spectrum and current diagnostic controversies. Adv Dent Res. 1996;10(1):3-8.
3. Kara-José N, Almeida GV, org. Senilidade ocular. São Paulo: Roca; 2001.
4. Moss SE, Klein R, Klein BE. Prevalence of and risk factors for dry eye syndrome. Arch Ophthalmol. 2000;118(9):1264-8.
5. Whitcher JP. Clinical diagnosis of the dry eye. Int Ophthalmol Clin. 1987;27 (1):7-24.
6. Toda I, Tsubota K. Practical double vital staining for ocular surface evaluation. Cornea. 1993;12(4):366-7.
7. Van Bijsterveld OP. Diagnostic tests in the sicca syndrome. Arch Ophthalmol. 1969;82(1):10-4.
8. Brown NA, Bron AJ, Harding JJ, Dewar HM. Nutrition supplements and the eye. Eye. 1998;12(Pt 1):127-33.
9. Ambrióso RJ, Stelzner SK, Boerner CF, Honan PR, McIntyre DJ. Nutrition and dry eye: the role of lipids. Review Refract Surg. 2002:29-32.
10. Barabino S, Rolando M, Camicione P, Ravera G, Zanardi S, Giuffrida S, et al. Systemic linoleic and gamma-linoleic acid therapy in dry eye syndrome with a inflammatory component. Cornea. 2003;22(2):97-101.
11. Simopoulos AP. Essential fatty acids in health and chronic disease. Am J Clin Nutr. 1999;70(3 Suppl.):560S-9S.
12. Miljanovic B, Trivedi KA, Dana MR, Gilbard JP, Buring JE, Schaumberg DA. Relation between dietary n-3 and n-6 fatty acids and clinically diagnosed dry eye syndrome in women. Am J Clin Nutr. 2005;82(4):887-93.
13. Clark WF, Kortas C, Heidenhein AP, Garland J, Spanner E, Parbtani A. Flaxseed in lupus nephritis: a two-year nonplacebo-controlled crossover study. J Am Coll Nutr. 2001;20(2 Suppl.):143-8.
14. Hasler CM, Kundrat S, Wool D. Functional foods and cardiovascular disease. Curr Atheroscler Rep. 2000;2(6):467-75.
15. Lemay A, Dodin S, Kadri N, Jacques H, Forest JC. Flaxseed dietary supplement versus hormone replacement therapy in hypercholesterolemic menopausal women. Obstet Gynecol. 2002;100(3):495-504.
16. Dabrosin C, Chen J, Wang L, Thompson LU. Flaxseed inhibits metastasis and decreases extracellular vascular endothelial growth factor in human breast cancer xenografts. Cancer Lett. 2002;185(1):31-7.
17. Hutchins AM, Martini MC, Olson BA, Thomas W, Slavin JL. Flaxseed consumption influences endogenous hormone concentration in postmenopausal women. Nutr Cancer. 2001;39(1):58-65.
18. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988;31(3):315-24.
19. Rolando M, Macri A, Carlandrea T, Calabria G. Use of a questionnaire for the diagnosis of tear-related ocular surface disease. Adv Exp Med Biol. 1998;438: 821-5.
20. Vitali C, Bombardieri S, Johnson R, Moutsopoulos HM, Alexander EL, Carsons SE, Daniels TE, Fox PC, Fox RI, Kassan SS, Pillemer SR, Talal N, Weisman MH; European Study Group on Classification Criteria for Sjögren's Syndrome. Classification criteria for Sjorgren's syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. 2002;61(6):554-8.
21. Murube J. Ojo Seco. Quito-Equador: Tecnimedia; 1997.
22. Schiffman RM, Christianson MD, Jacobsen G, Hirsch JD, Reis BL. Reliability and validity of the Ocular Surface Disease Index. Arch Ophthalmol. 2000; 118(5):615-21. Comment in: Arch Ophthalmol. 2001;119(3):456.
23. Barros JN, Mascaro VL, Gomes JA, Freitas D, Lima AL. Citologia de impressão da superfície ocular: técnica de exame e de coloração. Arq Bras Oftalmol. 2001;64(2):127-31.
24. Bueno de Camargo G, Nishiwaki-Dantas MC, Barros JN, Lake JC. Citologia de impressão na ceratoconjuntivite primaveril. Arq Bras Oftalmol. 2004;67 (6):877-81.
25. Nelson JD, Havenes VR, Cameron JD. Cellulose acetate impressions of the ocular surface. Dry eye states. Arch Ophthalmol. 1993;101(12):1869-72.
26. Zurier RB. Gammalinoleic acid treatment of rheumatoid arthritis. In: Kremer J, editor. Medicinal fatty acids in inflammation. Basel: Birkhauser Verlag; 1998. p.29-43.
27. Baudoin C, Brignole F, Becquet F, Pisella PJ, Goguel A. Flow cytometry in impression cytology specimens. A new method for evaluation of conjunctival inflammation. Invest Ophthalmol Vis Sci. 1997;38(7):1458-64.
28. Marsh P, Pflugfelder SC. Topical nonpreserved methylprednisolone therapy for keratoconjunctivitis sicca in Sjögren syndrome. Ophthalmology. 1999;106(4):811-6.
29. Stevenson D, Tauber J, Reis BL. Efficacy and safety of cyclosporin A ophthalmic emulsion in the treatment of moderate-to-severe dry eye disease: a dose-ranging randomized trial. The Cyclosporin A Phase 2 Study Group. Ophthalmology. 2000;107(5):967-74.
30. Aragona P, Giuffrida S, Bucolo C. Tear PGE1 levels in dry eye patients after treatment with essential fatty acids [abstract]. Invest Ophthalmol Vis Sci. 2001;42(Suppl.):259.
31. Pisella PJ, Brignole F, Debbasch C, Lozato PA, Creuzot-Garcher C, Bara J, et al. Flow cytometric analysis of conjunctival epithelium in ocular rosácea and keratoconjunctivitis sicca. Ophthalmology. 2000;107(10):1841-9.
32. Tsubota K, Fujihara T, Saito K, Takeuchi T. Conjunctival epithelium expression of HLA-DR in dry eye patients. Ophthalmologica. 1999;213(1):16-9.
33. Johanson G, Anderson G, Edwardson S, Björn AL, Manthorpe R, Attström R. Effects of mouthrinses with linseed extract Salinum® without/with chlorhexidine on oral conditions on patients with Sjögren syndrome. A double-blind crossover investigation. Gerodontology. 2001;18(2):87-94.
34. James MJ, Gibson RA, Cleland LG. Dietary polyunsaturated fatty acids and inflammatory mediator production. Am J Clin Nutr. 2000;71(1 Suppl.):343-8.
35. Stern ME, Gao J, Siemasko KF, Beuerman RW, Pflugfelder SC. The role of the lacrimal function unit in the pathophysiology of dry eye. Exp Eye Res. 2004;78(3):409-16.
Endereço para correspondência:
Manuel Neuzimar Pinheiro Junior
Rua Visconde de Porto Seguro, 5 - Quadra 1-A
Manaus (AM) - CEP 69058-090
E-mail: [email protected]; [email protected]
Recebido para publicação em 16.01.2007
Última versão recebida em 22.04.2007
Aprovação em 02.05.2007
Nota Editorial: Depois de concluída a análise do artigo sob sigilo editorial e com a anuência do Dr. Renato Ambrósio Jr. sobre a divulgação de seu nome como revisor, agradecemos sua participação neste processo.
Trabalho realizado no Ambulatório de Reumatologia do Hospital Universitário Getúlio Vargas da Universidade Federal do Amazonas - UFAM.