

Francisco Max Damico1
DOI: 10.1590/S0004-27492007000300030
RESUMO
Angiogênese é o processo de formação de vasos sangüíneos a partir de vasos preexistentes, que ocorre em condições fisiológicas e patológicas. É fenômeno complexo no qual participam inúmeras moléculas que estimulam e inibem a formação dos neovasos. O aumento da permeabilidade vascular e a neovascularização sub-retiniana são as causas da perda visual nas doenças proliferativas da retina, como a degeneração macular relacionada à idade e a retinopatia diabética, e o fator de crescimento do endotélio vascular ("vascular endothelial growth factor", VEGF) desempenha um papel muito importante nesse processo. Existem quatro isoformas da molécula de VEGF biologicamente ativas em seres humanos, das quais o VEGF165 é a isoforma predominante no olho humano, e existem evidências de que seja a isoforma responsável pela neovascularização patogênica no olho. Além de ser potente mitógeno de células endoteliais, o VEGF aumenta a permeabilidade vascular, inibe a apoptose das células endoteliais e promove migração de precursores de células endoteliais. O VEGF não é a única molécula cuja expressão está aumentada na angiogênese patológica. O fator de crescimento de fibroblasto ("basic fibroblast growth factor", bFGF), as angiopoetinas, o fator derivado do epitélio pigmentado ("pigment epithelium-derived factor", PEDF) e os fatores de adesão relacionados à matriz extracelular também exercem papel importante no balanço entre fatores pró- e antiangiogênicos. Todo o conhecimento adquirido sobre o mecanismo da angiogênese ocular patológica tem possibilitado o desenvolvimento de vários inibidores desse processo. Atualmente existem dois anticorpos anti-VEGF para uso intravítreo e outras abordagens terapêuticas do bloqueio da angiogênese ocular estão em fase de desenvolvimento. As novas drogas deverão ser armas poderosas no tratamento das principais causas de cegueira legal irreversível em indivíduos com mais de 65 anos.
Descritores: Neovascularização patológica; Degeneração macular; Retinopatia diabética; Inibidores da angiogênese; Agentes indutores da angiogênese
ABSTRACT
Angiogenesis is the process involving the growth of new blood vessels from preexisting vessels which occurs in both physiologic and pathological settings. It is a complex process controlled by a large number of modulating factors, the pro-and antiangiogenic factors. The underlying cause of vision loss in proliferative retinal diseases, such as age-related macular degeneration and proliferative diabetic retinopathy, are increased vascular permeability and choroidal neovascularization, and vascular endothelial growth factor (VEGF) plays a central role in this process. VEGF is produced in the eye by retinal pigment epithelium (RPE) cells and is upregulated by hypoxia. There are four major biologically active human isoforms, of which VEGF165 is the predominant in the human eye and appears to be the responsible for pathological ocular neovascularization. Besides being a potent and specific mitogen for endothelial cells, VEGF increases vascular permeability, inhibits endothelial cells apoptosis, and is a chemoattractant for endothelial cell precursors. VEGF is not the only growth factor involved in ocular neovascularization. Basic fibroblast growth factor (bFGF), angiopoietins, pigment epithelium-derived factor (PEDF), and adhesion molecules also play a role in the pro- and antiangiogenic balance. Advances in the understanding of the bases of pathological ocular angiogenesis and identification of angiogenesis regulators have enabled the development of novel therapeutic agents. Anti-VEGF antibodies have been developed for intravitreal use, and other approaches are currently under investigation. These new drugs may be powerful tools for the treatment of the leading causes of irreversible blindness in people over age 65.
Keywords: Neovasculatization, pathologic; Macular degeneration; Diabetic retinopathy; Angiogenesis inhibitors; Angiogenesis inducing agents
INTRODUÇÃO
A neovascularização ocorre em situações patológicas como uma tentativa de reparação de danos teciduais através da formação local de neovasos. No entanto, em retinopatias proliferativas, como a retinopatia diabética e a degeneração macular relacionada à idade (DMRI), geralmente a neovascularização traz consigo efeitos visuais devastadores.
O processo de formação de vasos sangüíneos é conhecido como angiogênese. Esse fenômeno ocorre em condições fisiológicas e patológicas. A angiogênese fisiológica ocorre durante a embriogênese, o crescimento dos tecidos e o ciclo reprodutivo da mulher, enquanto a angiogênese patológica é caracterizada pela neovascularização ineficaz (como no caso das retinopatias proliferativas) ou excessiva (como nos tumores)(1). Em 1971, Folkman sugeriu que o controle da angiogênese poderia ser útil no controle do crescimento tumoral(2). Esse conceito de antiangiogênese foi aplicado a outras doenças e vem sendo estudado extensivamente nos últimos anos.
A angiogênese é um fenômeno complexo no qual participam inúmeras moléculas que estimulam e inibem a formação dos neovasos. O desbalanço entre esses fatores pró- e anti-angiogênicos é a chave para a compreensão da angiogênese, e a partir do qual vêm emergindo novos tratamentos farmacológicos que vêm comprovar a hipótese de Folkman.
FISIOPATOGENIA DA NEOVASCULARIZAÇÃO DE CORÓIDE
Apesar do enorme esforço que vem sendo dedicado à elucidação do mecanismo patológico da neovascularização nas doenças da retina, ainda existem várias incertezas.
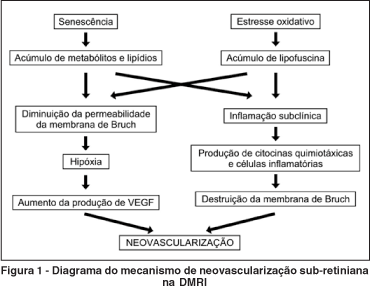
Uma característica comum à maioria das doenças retinianas nas quais ocorre neovascularização é a presença de algum grau de lesão da membrana de Bruch na mácula. Clinicamente, essa lesão pode ser visível à oftalmoscopia como alterações pigmentares, atrofia do epitélio pigmentado da retina (EPR), roturas traumáticas da coróide, estrias angióides e degeneração miópica. As boas condições das células do EPR, da membrana de Bruch e da coriocapilar são fundamentais para a homeostase e sobrevivência desse complexo, e a destruição de qualquer uma dessas camadas retinianas cursa, invariavelmente, com atrofia das outras duas.
Na DMRI, que é a principal causa de neovascularização sub-retiniana, existem evidências de que o envelhecimento diminui a capacidade do EPR de reciclar metabólitos resultantes do processo visual que ocorre nos fotorreceptores, e esses metabólitos se acumulam no espaço sub-retiniano. Além disso, o envelhecimento também promove acúmulo de lipídios na membrana de Bruch(3), tornando-a mais espessa e diminuindo a capacidade de difusão do oxigênio(4). As células do EPR, que normalmente são bastante permeáveis ao oxigênio devido à produção local do fator de crescimento do endotélio vascular ("vascular endothelial growth factor", VEGF), tornam-se menos permeáveis devido aos fatores mencionados acima, o que resulta numa menor capacidade de difusão de oxigênio e VEGF, levando a hipóxia dos fotorreceptores e atrofia da coriocapilar(5-6).
Outros fatores também contribuem para a hipóxia macular. Os olhos com DMRI encontram-se em estado de estresse oxidativo(7) pois há consumo de oxigênio muito elevado na mácula devido à alta taxa de metabolismo local e grande quantidade de ácidos graxos poliinsaturados. Essas características, associadas à exposição contínua à luz visível, causam dano oxidativo às células do EPR e acúmulo de lipofuscina na mácula. Oftalmoscopicamente, a lipofuscina é visível sob a forma de drusas, que são uma das primeiras manifestações clínicas da DMRI.
A presença dos metabólitos provenientes dos fotorreceptores, da lipofuscina e da degeneração oxidativa das células do EPR faz com que a mácula dos olhos com DMRI se encontre num estado inflamatório subclínico contínuo(8-9). A inflamação crônica leva à produção local de citocinas quimiotáxicas(8,10), migração de células inflamatórias para o espaço sub-retiniano (como macrófagos)(11-12) e provoca ativação do sistema complemento(13-14), causando destruição focal da membrana de Bruch. Os macrófagos também secretam VEGF, amplificando os seus efeitos locais(15).
Por fim, a grande quantidade de VEGF local induzida pela hipóxia(16) associada aos defeitos da membrana de Bruch(17) resultam na formação de neovasos que penetram no espaço sub-retiniano dessa provocando exsudação e hemorragia (Figura 1).
ANGIOGÊNESE E VEGF
Um dos mais importantes fatores pró-angiogênicos já identificados é o fator de crescimento do endotélio vascular (VEGF). O VEGF foi isolado pela primeira vez em 1983 como um potente fator indutor do aumento da permeabilidade vascular é 10.000 vezes mais potente que a histamina(18). Em 1989, identificou-se seu efeito mitótico sobre células do endotélio vascular e a molécula recebeu o nome de VEGF(19). Essas duas características (especificidade pelo endotélio vascular e grande potência) fazem do VEGF um fator pró-angiogênico muito importante na patogênese de doenças proliferativas.
O VEGF é produzido por macrófagos, linfócitos T, células tumorais e, no olho, pelas células do EPR, e o aumento na sua produção ocorre principalmente em condições de hipóxia, que é o principal indutor da produção de VEGF(20). Sua secreção é polarizada nas células do EPR: em condições normais, a secreção da porção basal é 2 a 7 vezes maior que a da porção apical, e sob hipóxia essa razão é muito maior(16). A expressão de receptores de VEGF também é maior no endotélio da coriocapilar que está voltado para o EPR(21), demonstrando indiretamente a importância do VEGF na manutenção da integridade da coriocapilar.
Existem pelo menos 4 isoformas da molécula de VEGF biologicamente ativas em seres humanos, contendo 121, 165, 189 e 206 aminoácidos, e cada uma desempenha um papel diferente no processo de angiogênese(22). O VEGF165 é a isoforma predominante no olho humano e existem evidências de que seja a isoforma responsável pela neovascularização patogênica no olho(23). No entanto, o VEGF165 não desempenha papel apenas na angiogênese patológica, essa isoforma contém toda a informação necessária para o desenvolvimento e a organização da rede vascular retiniana normal. Por sua vez, as isoformas VEGF189 e VEGF206 não parecem exercer nenhum papel na neovascularização patológica(22), enquanto o VEGF121 parece ser essencial para o funcionamento normal da vasculatura retiniana(23).
O VEGF estimula a angiogênese direta e indiretamente. Além de ser um potente mitógeno de células endoteliais(24-25), o VEGF aumenta a expressão celular de metaloproteinases, degradando a matriz extracelular e facilitando a penetração dos neovasos no tecido(26-27), ao mesmo tempo em que diminui a expressão endotelial dos inibidores de metaloproteinases(26-27). O VEGF também possui efeito pró-inflamatório(12,28-29) , neuroprotetor(30), e é um fator importante na estabilização e remodelação vasculares(31).
Tanto na embriogênese da retina quanto nas retinopatias proliferativas, a expressão de VEGF está temporal, espacial e quantitativamente relacionada com a formação de neovasos(32). Durante a embriogênese, a depleção de VEGF é letal aos embriões(33-34). Em modelo experimental com macacos, os níveis intra-oculares de VEGF estão diretamente relacionados à gravidade da neovascularização(32-35). Em situações patológicas, os níveis de VEGF estão elevados em olhos com retinopatia diabética proliferativa e a forma isquêmica da oclusão da veia central da retina(36-37). Da mesma forma, encontram-se elevados nas células do EPR e de vasos coroideanos de máculas com DMRI(38). O estudo de membranas neovasculares de olhos com DMRI retiradas cirurgicamente também revela aumento na expressão de VEGF em relação à membranas secundárias a retinopatias não proliferativas(39-41).
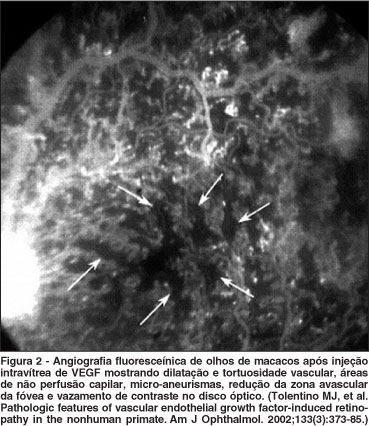
Os estudos em animais mostram que a expressão aumentada de VEGF é uma condição necessária para a indução da neovascularização ocular, e que somente esse aumento é suficiente para induzir esse processo. O aumento da expressão de VEGF no EPR e nos fotorreceptores de ratos promove aumento da permeabilidade vascular, aumento da adesão leucocitária e formação de neovasos de coróide(35). Em macacos, a injeção intravítrea de VEGF provoca o aparecimento de neovasos retinianos cujas características histológicas e funcionais são muito semelhantes aos encontrados nas retinopatias proliferativas(42-43) (Figura 2). Por outro lado, a injeção intravítrea de anticorpo anti-VEGF previne a formação de neovasos sub-retinianos(23) (Figura 3).
Todos esses resultados mostram a importância do VEGF no processo de angiogênese, e abriram caminho para as novas terapias antiangiogênicas de retinopatias proliferativas.
Outros fatores envolvidos na angiogênese
O VEGF não é a única molécula cuja expressão está aumentada na angiogênese patológica, embora pareça ser a principal. Outras moléculas, como o fator de crescimento de fibroblasto ("basic fibroblast growth factor", bFGF), as angiopoetinas, o fator derivado do epitélio pigmentado ("pigment epithelium-derived factor", PEDF), e os fatores de adesão relacionados à matriz extracelular também exercem um papel importante no balanço entre fatores pró- e antiangiogênicos.
Embora seja um fator muito importante na angiogênese dos tumores, o papel do fator de crescimento de fibroblasto (bFGF) na neovascularização ocular ainda não está bem estabelecido. Os níveis de bFGF encontram-se aumentados em membranas neovasculares sub-retinianas retiradas cirurgicamente(40-41,44), e em neovascularização de coróide induzida por laser(45). Em coelhos, o implante intravítreo de bFGF induz neovascularização sub-retiniana(46). No entanto, a sua ablação genética em camundongos não é capaz de impedir o desenvolvimento de neovascularização(47), sugerindo que o bFGF deva desempenhar um papel secundário ao VEGF na formação dos neovasos oculares.
As angiopoetinas são fatores de maturação e estabilização de neovasos e são altamente específicas para o endotélio vascular, assim como o VEGF(48). A angiopoetina 1 promove maturação dos neovasos induzidos pelo VEGF, enquanto a angiopoetina 2 aumenta a neovascularização estimulada pelo VEGF(48). Ambas angiopoetinas 1 e 2 estão presentes em membranas neovasculares(49). Embora a regulação da expressão dessas angiopoetinas e sua relação com as membranas neovasculares sub-retinianas sejam complexas(48), a inibição dessas moléculas pode ser uma abordagem terapêutica interessante.
O fator derivado do epitélio pigmentado (PEDF) é um fator neurotrófico de fotorreceptores e inibidor da angiogênese, produzido em grande quantidade pelo EPR(50). O PEDF age inibindo a migração endotelial(51) e induzindo apoptose das células endoteliais neoformadas(52). Interessantemente, e ao contrário do VEGF, sua expressão é estimulada pela maior tensão local de oxigênio e inibida pela hipóxia(51), e por isso supõe-se que o PEDF possa ser um antagonista natural do VEGF. Acredita-se, inclusive, que a ausência de vasos na córnea e no vítreo seja devida a grande quantidade de PEDF encontrada nessas estruturas. O vítreo de pacientes com retinopatia diabética proliferativa contém níveis mais baixos de PEDF em relação ao vítreo de olhos sem retinopatia proliferativa, e o inverso ocorre com os níveis de VEGF(53-55). A concentração vítrea de PEDF também é menor em olhos com DMRI(54). Embora seja um potente fator antiangiogênico, a administração sistêmica de doses diferentes de PEDF provoca resultados controversos em relação à neovascularização retiniana induzida por laser: enquanto doses baixas de PEDF diminuem a taxa de neovascularização, doses altas aumentam a taxa(48). Esses resultados geram dúvidas em relação ao potencial do uso de PEDF para o controle da angiogênese.
A invasão e migração de células endoteliais através da matriz extracelular durante a angiogênese são modulados pelas integrinas, uma família de moléculas de adesão celular. As integrinas facilitam a migração através da interação com moléculas da matriz extracelular. Esse processo é potencializado pela secreção de enzimas proteolíticas chamadas metaloproteinases (MMPs) e é modulado por inibidores tissulares das MMPs ("tissue inhibitors of metalloproteinases", TIMPs). Várias MMPs estão presentes em membranas neovasculares secundárias à DMRI(56-57), e o próprio VEGF pode induzir a sua produção(58). Níveis aumentados de MMP-2 são detectáveis no espaço sub-retiniano de olhos com DMRI(59), assim como de MMP-2 e MMP-9 na membrana de Bruch de olhos de pacientes idosos(60). No entanto, essas enzimas se encontram na forma inativa, e a sua importância na neovascularização ocular ainda não está bem esclarecida.
TERAPIAS ANTIANGIOGÊNICAS PARA DOENÇAS PROLIFERATIVAS DA RETINA
Todo o conhecimento adquirido sobre o mecanismo de angiogênese ocular tem possibilitado o desenvolvimento de vários inibidores desse processo. Como o denominador comum das retinopatias proliferativas é o aumento da permeabilidade e a proliferação vascular, os esforços têm se concentrado na inibição do principal fator responsável por essas alterações: o VEGF.
Existem atualmente dois anticorpos produzidos especificamente para o bloqueio da interação do VEGF com o seu receptor no olho: pegaptanibe sódico e ranibizumabe. O pegaptanibe sódico é um aptâmero que se liga com muita afinidade e especificidade à molécula de VEGF165, impedindo sua interação com o receptor de VEGF(61). O ranibizumabe é um fragmento de anticorpo monoclonal recombinante humanizado que inibe todas as isoformas do VEGF(62). Os estudos clínicos para avaliar segurança e eficácia dessas drogas mostram que a injeção intravítrea produz benefícios anatômico e visual aos pacientes, independentemente do subtipo angiográfico e tamanho das membranas neovasculares e da visão inicial, e os efeitos colaterais locais e sistêmicos são insignificantes(61-65).
O bevacizumabe é um anticorpo monoclonal recombinante humanizado completo do qual deriva o ranibizumabe(66), e vem sendo usado para o tratamento da forma neovascular da DMRI e da retinopatia diabética proliferativa. A droga foi aprovada para o tratamento sistêmico do câncer de cólon com metástase, mas vem sendo utilizada na forma de injeções intravítreas, fora dos padrões para os quais foi desenvolvida. Alguns estudos clínicos e experimentais com período de seguimento curto têm demonstrado ausência de efeitos adversos oculares e sistêmicos após a injeção intravítrea de bevacizumabe(67-70), e os resultados do tratamento da forma neovascular da DMRI com bevacizumabe parecem ser bons(68,70-71), mas não existem estudos que demonstrem sua segurança quando injetado dentro do olho.
A disseminação sistêmica dessas drogas após a injeção intravítrea é um motivo de preocupação. Embora os estudos mostrem que existe passagem muito pequena das drogas através do olho, não se conhecem os efeitos da presença sistêmica crônica de baixas doses desses antiangiogênicos. Como a angiogênese fisiológica é fundamental para a formação de vasos colaterais importantes para a sobrevivência de áreas hipóxicas em outros órgãos, somente a experiência com o uso dessas drogas será capaz de mostrar a segurança sistêmica e até mesmo ocular.
Existem outras abordagens terapêuticas do bloqueio da angiogênese ocular em fase de desenvolvimento. Entre elas, destacam-se a terapia gênica com a administração intra-vítrea de PEDF, o VEGF Trap, o siRNA ("small interfering RNAs"), e a administração sistêmica de lactato de esqualamina. Todas possuem estudos pré-clínicos mostrando sua eficiência no bloqueio da angiogênese e os estudos clínicos estão nas fases I e II.
CONCLUSÃO
O tratamento das retinopatias proliferativas vem sendo rapidamente aprimorado. O melhor conhecimento dos mecanismos que levam à angiogênese ocular patológica tem permitido o desenvolvimento de novas drogas para o tratamento da forma neovascular da DMRI, da retinopatia diabética e das oclusões vasculares da retina, o que as tornarão armas preciosas no tratamento das principais causas de cegueira legal irreversível em indivíduos com mais de 65 anos.
REFERÊNCIAS
1. Folkman J, Klagsbrun M. Angiogenic factors. Science. 1987;235(4787):442-7.
2. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285(21):1182-6. Review.
3. Holz FG, Sheraidah G, Pauleikhoff D, Bird AC. Analysis of lipid deposits extracted from human macular and peripheral Bruch's membrane. Arch Ophthalmol. 1994;112(3):402-6.
4. Bird AC. The Bowman lecture. Towards an understanding of age-related macular disease. Eye. 2003;17(4):457-66.
5. Ramrattan RS, van der Schaft TL, Mooy CM, de Bruijn WC, Mulder PG, de Jong PT. Morphometric analysis of Bruch's membrane, the choriocapillaris, and the choroid in aging. Invest Ophthalmol Vis Sci. 1994;35(6):2857-64.
6. Lutty G, Grunwald J, Majji AB, Uyama M, Yoneya S. Changes in choriocapillaris and retinal pigment epithelium in age-related macular degeneration. Mol Vis. 1999;5:35.
7. Beatty S, Koh H, Phil M, Henson D, Boulton M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Surv Ophthalmol. 2000;45(2):115-34. Review.
8. Hageman GS, Luthert PJ, Victor Chong NH, Johnson LV, Anderson DH, Mullins RF. An integrated hypothesis that considers drusen as biomarkers of immune-mediated processes at the RPE-Bruch's membrane interface in aging and age-related macular degeneration. Prog Retin Eye Res. 2001;20(6):705-32.
9. Anderson DH, Mullins RF, Hageman GS, Johnson LV. A role for local inflammation in the formation of drusen in the aging eye. Am J Ophthalmol. 2002;134(3):411-31.
10. Higgins GT, Wang JH, Dockery P, Cleary PE, Redmond HP. Induction of angiogenic cytokine expression in cultured RPE by ingestion of oxidized photoreceptor outer segments. Invest Ophthalmol Vis Sci. 2003;44(4):1775-82.
11. Espinosa-Heidmann DG, Suner IJ, Hernandez EP, Monroy D, Csaky KG, Cousins SW. Macrophage depletion diminishes lesion size and severity in experimental choroidal neovascularization. Invest Ophthalmol Vis Sci. 2003; 44(8):3586-92.
12. Sakurai E, Anand A, Ambati BK, van Rooijen N, Ambati J. Macrophage depletion inhibits experimental choroidal neovascularization. Invest Ophthalmol Vis Sci. 2003;44(8):3578-85.
13. Van der Schaft TL, Mooy CM, de Bruijn WC, de Jong PT. Early stages of age-related macular degeneration: an immunofluorescence and electron microscopy study. Br J Ophthalmol. 1993;77(10):657-61.
14. Johnson LV, Leitner WP, Staples MK, Anderson DH. Complement activation and inflammatory processes in Drusen formation and age related macular degeneration. Exp Eye Res. 2001;73(6):887-96.
15. Miyamoto K, Khosrof S, Bursell SE, Moromizato Y, Aiello LP, Ogura Y, Adamis AP. Vascular endothelial growth factor (VEGF)-induced retinal vascular permeability is mediated by intercellular adhesion molecule-1 (ICAM-1). Am J Pathol. 2000;156(5):1733-9.
16. Blaauwgeers HG, Holtkamp GM, Rutten H, Witmer AN, Koolwijk P, Partanen TA, et al. Polarized vascular endothelial growth factor secretion by human retinal pigment epithelium and localization of vascular endothelial growth factor receptors on the inner choriocapillaris. Evidence for a trophic paracrine relation. Am J Pathol. 1999;155(2):421-8.
17. Krzystolik MG, Afshari MA, Adamis AP, Gaudreault J, Gragoudas ES, Michaud NA, et al. Prevention of experimental choroidal neovascularization with intra-vitreal anti-vascular endothelial growth factor antibody fragment. Arch Ophthalmol. 2002;120(3):338-46.
18. Senger DR, Galli SJ, Dvorak AM, Perruzzi CA, Harvey VS, Dvorak HF. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science. 1983;219(4587):983-5.
19. Senger DR, Connolly DT, Van de Water L, Feder J, Dvorak HF. Purification and NH2-terminal amino acid sequence of guinea pig tumor-secreted vascular permeability factor. Cancer Res. 1990;50(6):1774-8.
20. Shima DT, Adamis AP, Ferrara N, Yeo KT, Yeo TK, Allende R, et al. Hypoxic induction of endothelial cell growth factors in retinal cells: identification and characterization of vascular endothelial growth factor (VEGF) as the mitogen. Mol Med. 1995;1(2):182-93.
21. Honda M, Sakamoto T, Ishibashi T, Inomata H, Ueno H. Experimental subretinal neovascularization is inhibited by adenovirus-mediated soluble VEGF/flt-1 receptor gene transfection: a role of VEGF and possible treatment for SRN in age-related macular degeneration. Gene Ther. 2000;7(11):978-85.
22. Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev. 2004;25(4):581-611.
23. Ishida S, Usui T, Yamashiro K, Kaji Y, Amano S, Ogura Y, et al. VEGF164-mediated inflammation is required for pathological, but not physiological, ischemia-induced retinal neovascularization. J Exp Med. 2003;198(3):483-9.
24. Leung DW, Cachianes G, Kuang WJ, Goeddel DV, Ferrara N. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science. 1989;246 (4935):1306-9.
25. Ferrara N, Houck K, Jakeman L, Leung DW. Molecular and biological properties of the vascular endothelial growth factor family of proteins. Endocr Rev. 1992;13(1):18-32.
26. Lamoreaux WJ, Fitzgerald ME, Reiner A, Hasty KA, Charles ST. Vascular endothelial growth factor increases release of gelatinase A and decreases release of tissue inhibitor of metalloproteinases by microvascular endothelial cells in vitro. Microvasc Res. 1998;55(1):29-42.
27. Hiratsuka S, Nakamura K, Iwai S, Murakami M, Itoh T, Kijima H, et al. MMP9 induction by vascular endothelial growth factor receptor-1 is involved in lung-specific metastasis. Cancer Cell. 2002;2(4):289-300.
28. Moromizato Y, Stechschulte S, Miyamoto K, Murata T, Tsujikawa A, Joussen AM, Adamis AP. CD18 and ICAM-1-dependent corneal neovascularization and inflammation after limbal injury. Am J Pathol. 2000;157(4): 1277-81.
29. Usui T, Ishida S, Yamashiro K, Kaji Y, Poulaki V, Moore J, et al. VEGF164(165) as the pathological isoform: differential leukocyte and endothelial responses through VEGFR1 and VEGFR2. Invest Ophthalmol Vis Sci. 2004;45(2):368-74.
30. Storkebaum E, Carmeliet P. VEGF: a critical player in neurodegeneration. J Clin Invest. 2004;113(1):14-8.
31. Benjamin LE, Hemo I, Keshet E. A plasticity window for blood vessel remodelling is defined by pericyte coverage of the preformed endothelial network and is regulated by PDGF-B and VEGF. Development. 1998;125(9):1591-8.
32. Miller JW, Adamis AP, Shima DT, D'Amore PA, Moulton RS, O'Reilly MS, et al. Vascular endothelial growth factor/vascular permeability factor is temporally and spatially correlated with ocular angiogenesis in a primate model. Am J Pathol. 1994;145(3):574-84.
33. Carmeliet P, Ferreira V, Breier G, Pollefeyt S, Kieckens L, Gertsenstein M, et al. Abnormal blood vessel development and lethality in embryos lacking a single VEGF allele. Nature. 1996;380(6573):435-9.
34. Ferrara N, Carver-Moore K, Chen H, Dowd M, Lu L, O'Shea KS, Powell-Braxton L, Hillan KJ, Moore MW. Heterozygous embryonic lethality induced by targeted inactivation of the VEGF gene. Nature. 1996;380(6573):439-42.
35. Spilsbury K, Garrett KL, Shen WY, Constable IJ, Rakoczy PE. Overexpression of vascular endothelial growth factor (VEGF) in the retinal pigment epithelium leads to the development of choroidal neovascularization. Am J Pathol. 2000;157(1):135-44. Erratum in: Am J Pathol. 2000;157(4): 1413.
36. Adamis AP, Miller JW, Bernal MT, D'Amico DJ, Folkman J, Yeo TK, Yeo KT. Increased vascular endothelial growth factor levels in the vitreous of eyes with proliferative diabetic retinopathy. Am J Ophthalmol. 1994;118(4):445-50.
37. Aiello LP, Avery RL, Arrigg PG, Keyt BA, Jampel HD, Shah ST, et al. Vascular endothelial growth factor in ocular fluid of patients with diabetic retinopathy and other retinal disorders. N Engl J Med. 1994;331(22):1480-7.
38. Kliffen M, Sharma HS, Mooy CM, Kerkvliet S, de Jong PT. Increased expression of angiogenic growth factors in age-related maculopathy. Br J Ophthalmol. 1997;81(2):154-62.
39. Lopez PF, Sippy BD, Lambert HM, Thach AB, Hinton DR. Transdifferentiated retinal pigment epithelial cells are immunoreactive for vascular endothelial growth factor in surgically excised age-related macular degeneration-related choroidal neovascular membranes. Invest Ophthalmol Vis Sci. 1996;37(5):855-68.
40. Frank RN, Amin RH, Eliott D, Puklin JE, Abrams GW. Basic fibroblast growth factor and vascular endothelial growth factor are present in epiretinal and choroidal neovascular membranes. Am J Ophthalmol. 1996;122(3):393-403.
41. Kvanta A, Algvere PV, Berglin L, Seregard S. Subfoveal fibrovascular membranes in age-related macular degeneration express vascular endothelial growth factor. Invest Ophthalmol Vis Sci. 1996;37(9):1929-34.
42. Tolentino MJ, Miller JW, Gragoudas ES, Jakobiec FA, Flynn E, Chatzistefanou K, et al. Intravitreous injections of vascular endothelial growth factor produce retinal ischemia and microangiopathy in an adult primate. Ophthalmology. 1996;103(11):1820-8.
43. Tolentino MJ, McLeod DS, Taomoto M, Otsuji T, Adamis AP, Lutty GA. Pathologic features of vascular endothelial growth factor-induced retinopathy in the nonhuman primate. Am J Ophthalmol. 2002;133(3):373-85.
44. Amin R, Puklin JE, Frank RN. Growth factor localization in choroidal neovascular membranes of age-related macular degeneration. Invest Ophthalmol Vis Sci. 1994;35(8):3178-88.
45. Ogata N, Matsushima M, Takada Y, Tobe T, Takahashi K, Yi X, et al. Expression of basic fibroblast growth factor mRNA in developing choroidal neovascularization. Curr Eye Res. 1996;15(10):1008-18.
46. Kimura H, Sakamoto T, Hinton DR, Spee C, Ogura Y, Tabata Y, et al. A new model of subretinal neovascularization in the rabbit. Invest Ophthalmol Vis Sci. 1995;36(10):2110-9.
47. Tobe T, Ortega S, Luna JD, Ozaki H, Okamoto N, Derevjanik NL, et al. Targeted disruption of the FGF2 gene does not prevent choroidal neovascularization in a murine model. Am J Pathol. 1998;153(5):1641-6.
48. Ambati J, Ambati BK, Yoo SH, Ianchulev S, Adamis AP. Age-related macular degeneration: etiology, pathogenesis, and therapeutic strategies. Surv Ophthalmol. 2003;48(3):257-93.
49. Otani A, Takagi H, Oh H, Koyama S, Matsumura M, Honda Y. Expressions of angiopoietins and Tie2 in human choroidal neovascular membranes. Invest Ophthalmol Vis Sci. 1999;40(9):1912-20.
50. Tombran-Tink J, Shivaram SM, Chader GJ, Johnson LV, Bok D. Expression, secretion, and age-related downregulation of pigment epithelium-derived factor, a serpin with neurotrophic activity. J Neurosci. 1995;15(7 Pt 1):4992-5003.
51. Dawson DW, Volpert OV, Gillis P, Crawford SE, Xu H, Benedict W, Bouck NP. Pigment epithelium-derived factor: a potent inhibitor of angiogenesis. Science. 1999;285(5425):245-8.
52. Stellmach V, Crawford SE, Zhou W, Bouck N. Prevention of ischemia-induced retinopathy by the natural ocular antiangiogenic agent pigment epithelium-derived factor. Proc Natl Acad Sci U S A. 2001;98(5):2593-7.
53. Spranger J, Osterhoff M, Reimann M, Mohlig M, Ristow M, Francis MK, et al. Loss of the antiangiogenic pigment epithelium-derived factor in patients with angiogenic eye disease. Diabetes. 2001;50(12):2641-5.
54. Holekamp NM, Bouck N, Volpert O. Pigment epithelium-derived factor is deficient in the vitreous of patients with choroidal neovascularization due to age-related macular degeneration. Am J Ophthalmol. 2002;134(2):220-7.
55. Ogata N, Nishikawa M, Nishimura T, Mitsuma Y, Matsumura M. Unbalanced vitreous levels of pigment epithelium-derived factor and vascular endothelial growth factor in diabetic retinopathy. Am J Ophthalmol. 2002; 134(3):348-53.
56. Steen B, Sejersen S, Berglin L, Seregard S, Kvanta A. Matrix metalloproteinases and metalloproteinase inhibitors in choroidal neovascular membranes. Invest Ophthalmol Vis Sci. 1998;39(11):2194-200.
57. Kadonosono K, Yazama F, Itoh N, Sawada H, Ohno S. Expression of matrix metalloproteinase-7 in choroidal neovascular membranes in age-related macular degeneration. Am J Ophthalmol. 1999;128(3):382-4.
58. Unemori EN, Ferrara N, Bauer EA, Amento EP. Vascular endothelial growth factor induces interstitial collagenase expression in human endothelial cells. J Cell Physiol. 1992;153(3):557-62.
59. Plantner JJ, Jiang C, Smine A. Increase in interphotoreceptor matrix gelatinase A (MMP-2) associated with age-related macular degeneration. Exp Eye Res. 1998;67(6):637-45.
60. Guo L, Hussain AA, Limb GA, Marshall J. Age-dependent variation in metalloproteinase activity of isolated human Bruch's membrane and choroid. Invest Ophthalmol Vis Sci. 1999;40(11):2676-82.
61. Gragoudas ES, Adamis AP, Cunningham ET Jr, Feinsod M, Guyer DR; VEGF Inhibition Study in Ocular Neovascularization Clinical Trial Group. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med. 2004;351(27):2805-16.
62. Heier JS, Antoszyk AN, Pavan PR, Leff SR, Rosenfeld PJ, Ciulla TA, et al. Ranibizumab for treatment of neovascular age-related macular degeneration: a phase I/II multicenter, controlled, multidose study. Ophthalmology. 2006; 113(4):642.e1-4.
63. VEGF Inhibition Study in Ocular Neovascularization (V.I.S.I.O.N.) Clinical Trial Group; D'Amico DJ, Masonson HN, Patel M, Adamis AP, Cunningham ET Jr, Guyer DR, Katz B. Pegaptanib sodium for neovascular age-related macular degeneration: two-year safety results of the two prospective, multicenter, controlled clinical trials. Ophthalmology. 2006;113(6):992-1001.e6.
64. Rosenfeld PJ, Brown DM, Heier JS, Boyer DS, Kaiser PK, Chung CY, Kim RY; MARINA Study Group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1419-31.
65. Brown DM, Kaiser PK, Michels M, Soubrane G, Heier JS, Kim RY, Sy JP, Schneider S; ANCHOR Study Group. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1432-44.
66. Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350(23):2335-42.
67. Manzano RP, Peyman GA, Khan P, Kivilcim M. Testing intravitreal toxicity of bevacizumab (Avastin). Retina. 2006;26(3):257-61.
68. Costa RA, Jorge R, Calucci D, Cardillo JA, Melo LA Jr, Scott IU. Intravitreal bevacizumab for choroidal neovascularization caused by AMD (IBeNA Study): results of a phase 1 dose-escalation study. Invest Ophthalmol Vis Sci. 2006;47(10):4569-78.
69. Luthra S, Narayanan R, Marques LE, Chwa M, Kim DW, Dong J, et al. Evaluation of in vitro effects of bevacizumab (Avastin) on retinal pigment epithelial, neurosensory retinal, and microvascular endothelial cells. Retina. 2006;26(5):512-8.
70. Rich RM, Rosenfeld PJ, Puliafito CA, Dubovy SR, Davis JL, Flynn HW Jr, et al. Short-term safety and efficacy of intravitreal bevacizumab (Avastin) for neovascular age-related macular degeneration. Retina. 2006;26(5):495-511.
71. Spaide RF, Laud K, Fine HF, Klancnik JM Jr, Meyerle CB, Yannuzzi LA, et al. Intravitreal bevacizumab treatment of choroidal neovascularization secondary to age-related macular degeneration. Retina. 2006;26(4):383-90.
Endereço para correspondência:
Francisco Max Damico
Rua Barata Ribeiro, 414 - Conj. 11
São Paulo (SP) CEP 01308-000
E-mail: [email protected]
Recebido para publicação em 27.04.2006
Última versão recebida em 16.10.2006
Aprovação em 24.11.2006
O autor não tem interesse comercial em nenhum dos produtos citados nesta revisão.
Trabalho realizado na Clínica Oftalmológica da Faculdade de Medicina da Universidade de São Paulo - USP e no Laboratório da Visão do Instituto de Psicologia da Universidade de São Paulo - USP.