

José Bonifácio Barbosa Junior1; Caio Vinicius Saito Regatieri2; Terezinha Maria de Paiva3; Margareth Aparecida Benega4; Maria Akiko Ishida5; Kátia Oliveira Corrêa6; Denise de Freitas7; Rubens Belfort Junior8
DOI: 10.1590/S0004-27492007000300010
RESUMO
OBJETIVO: Avaliar a utilização do RPS Adenodetector®, como método diagnóstico de pacientes com quadro clínico de conjuntivite adenoviral. MÉTODOS: Análise de série de casos consecutivos de pacientes com diagnóstico clínico de ceratoconjuntivite adenoviral submetidos comparativamente ao teste RPS Adenodetector® e a raspado conjuntival para cultura de vírus. RESULTADOS: Dos 11 pacientes avaliados, 10 pacientes apresentavam acometimento unilateral. Em relação ao tempo de início dos sintomas no momento da colheita, 5 (45,5%) pacientes apresentavam dois dias de história, 5 (45,5%) apresentavam três dias e 1 (9,1%) apresentava 7 dias. A cultura para adenovírus foi positiva em 8 pacientes (73%) e o RPS Adenodetector® foi positivo em 9 pacientes (82%). Oito pacientes apresentaram o teste rápido e cultura positiva. Um paciente apresentou teste RPS Adenodetector® positivo com cultura negativa. Os dois pacientes com teste RPS Adenodetector® negativo apresentaram cultura negativa. O RPS Adenodetector® mostrou sensibilidade de 100% e especificidade de 67% adotando-se a cultura de vírus como exame padrão-ouro para o diagnóstico de conjuntivite adenoviral. CONCLUSÃO: O RPS Adenodetector® foi útil para o diagnóstico de conjuntivite adenoviral e pode auxiliar na orientação do paciente quanto ao contágio e disseminação da doença.
Descritores: Conjuntivite viral; Infecções por adenoviridae; Cromatografia; Cultura de vírus
ABSTRACT
PURPOSE: To evaluate the RPS Adenodetector®, a rapid immunochromatographic test, in the diagnosis of patients with clinical overt adenoviral conjunctivitis. METHODS: Consecutive case series. Patients underwent conjunctiva scraping for RPS Adenodetector® test and culture to identify adenovirus. RESULTS: A total of 11 patients were studied, and 10 had unilateral disease. Five (45.5%) had symptoms for 2 days, 5 for three days, and 1 for 7 days. Adenovirus culture was positive in 8 patients (73%) and RPS Adenodetector® was positive in 9 (82%) patients. Eight patients had adenovirus identification by both methods. In one patient the RPS Adenodetector® was positive in contrast to a negative culture. The two patients revealing negative RPS Adenodetector® results also had negative cultures. The sensitivity was 100% and the specificity was 67%. CONCLUSION: The RPS Adenodetector® is a useful tool in the rapid diagnosis of adenovirus conjunctivitis and may contribute to the spread control of this highly contagious disease.
Keywords: Conjunctivitis, viral; Adenoviridae infections; Chromatography; Virus cultivation
INTRODUÇÃO
O adenovírus é uma das causas mais freqüentes de infecção conjuntival em todo o mundo, e embora normalmente não resulte em perda visual, é causa freqüente de abstenção em escolas e trabalho, com elevado custo econômico e social(1-2). Além dos olhos, o adenovírus é capaz de causar infecções no trato respiratório superior(3) e intestino(4).
A conjuntivite adenoviral é bastante contagiosa, com ocorrência mundial esporádica e epidêmica(5), principalmente durante o verão. As três principais formas clínicas de apresentação são a ceratoconjuntivite epidêmica, a febre faringoconjuntival e a conjuntivite folicular aguda inespecífica(6). O contágio ocorre através do aperto de mãos, superfícies contaminadas, instrumentos oftalmológicos infectados, piscinas, colírios, entre outros(6-8). O período de contágio estende-se em média até o 14º dia após o início do quadro clínico(6).
Os sinais e sintomas são bastante clássicos (hiperemia conjuntival associada à presença de folículos principalmente em fórnice inferior, fotofobia, sensação de corpo estranho e lacrimejamento) e facilmente levam à hipótese diagnóstica de infecção; no entanto, casos com clínica mais duvidosa podem ocorrer(6) e a confirmação da etiologia da infecção torna-se importante para o controle de epidemias, especialmente nestes casos atípicos.
O isolamento através da cultura do vírus consiste no padrão-ouro para diagnóstico, mas apresenta desvantagens como alto custo, necessidade de organismos viáveis, meio de transporte especial para o laboratório e tempo de incubação de dias a semanas, prejudicando a tomada de decisões de controle de contágio mais precisas e rápidas(9-10).
Técnicas de detecção de antígenos requerem menos tempo e não necessitam de organismos viáveis. A sensibilidade e especificidade são altamente variáveis entre os métodos disponíveis (imunoensaio enzimático, imunofluorescência, imunocromatografia, aglutinação látex específica e imunofiltração)(10).
Dentre os testes de diagnóstico rápidos para detecção de adenovírus temos comercialmente disponíveis o Adenoclone®, SAS Adenotest® e o RPS Adenodetector® (teste rápido). O RPS Adenodetector® foi recentemente aprovado pelo FDA (www.fda.gov/cdrh/pdf5/K052092.pdf) e utiliza tecnologia baseada na imunocromatografia de fluxo lateral. Antígenos adenovirais quando presentes no paciente são capturados entre dois anticorpos monoclonais antígenos específicos.
O objetivo do estudo consistiu na avaliação do RPS Adenodetector® como método diagnóstico em pacientes com quadro clínico de conjuntivite adenoviral.
MÉTODOS
Foram avaliados 11 pacientes consecutivos no pronto socorro de oftalmologia do Hospital São Paulo no período de abril a maio de 2006 com quadro clínico sugestivo de ceratoconjuntivite adenoviral uni ou bilateral. O diagnóstico clínico foi baseado na história e avaliação oftalmológica típica de conjuntivite aguda (sintomas, e sinais como de folículos na conjuntiva tarsal inferior, linfadenopatia pré-auricular, presença de pseudomembranas conjuntivais, ceratite ponteada e secreção ocular mucóide) e rastreamento de possível contato de contágio (questionamento sobre colegas de trabalho, parentes, entre outros, com sinais de conjuntivite).
Os pacientes foram submetidos de maneira aleatória e consecutiva aos exames de imonocromatografia e cultura, com as técnicas descritas a seguir.
O RPS Adenodetector® (Rapid Pathogen Screening, Inc, 101 Phillips Park Drive, South Williamsport, PA 17702) consiste de um kit com três componentes: um coletor com esponja em uma extremidade, um cassete onde se realiza a leitura do resultado através da observação da tira na sua extremidade, e um frasco contendo solução reagente, onde é imersa a tira absorvente do cassete. Após a instilação de colírio anestésico (cloridrato de proparacaína a 0,5%) a conjuntiva tarsal inferior foi raspada de maneira suave com o coletor. Feito isso, encaixou-se o coletor no cassete que em seguida foi imerso na solução reagente por 15 segundos. Após isto se aguardou 10 minutos para a leitura do resultado com mudança de cor na tira. O teste positivo mostra duas linhas em vermelho; o negativo mostra somente uma linha em vermelho que consiste na linha controle. Caso nenhuma linha apareça, o teste é considerado inválido, conforme instruções do fabricante.
A cultura viral também foi realizada após a instilação do mesmo colírio anestésico e através de raspado conjuntival, com cotonete estéril. O material obtido foi colocado em tubos de ensaio estéreis de 3 ml contendo meio de transporte viral específico contendo cloreto de sódio, peptona e extrato de carne e posteriormente inoculado em cultura de células HEp-2 com posterior identificação do vírus caso houvesse crescimento.
Em relação à análise estatística, foi empregado o teste Kappa para se avaliar a concordância entre os resultados da cultura viral e o RPS Adenodetector®. Adicionalmente, foram calculadas a sensibilidade e especificidade do teste RPS Adenodetector® considerando-se a cultura viral como teste padrão-ouro. Os intervalos de confiança de 95% para sensibilidade e especificidade foram calculados a partir da distribuição binomial, sendo desta forma exatos e não sendo uma aproximação a partir da distribuição normal.
RESULTADOS
Dos 11 pacientes avaliados, 9 (82%) eram do sexo feminino. A idade dos pacientes variou de 16 a 43 anos com média de 29 anos.
Quanto ao início dos sintomas no momento da colheita, 5 (45,5%) pacientes apresentavam dois dias de história, 5 (45,5%) três dias e 1 (9,1%) sete dias.
Dez (90,9%) pacientes apresentavam acometimento unilateral e 1 (9,1%) apresentou acometimento bilateral com início dos sintomas no segundo olho de dois dias após o início no primeiro olho. Dois (18%) pacientes estavam em uso de medicamento ocular (colírio de cloranfenicol) no momento da colheita.
A cultura para adenovírus foi positiva em 8 pacientes (72,7%), enquanto que o RPS Adenodetector® foi positivo em 9 (81,8%). Oito pacientes apresentaram teste rápido e cultura positivos. Um paciente apresentou teste rápido positivo com cultura negativa. Todos os pacientes com teste rápido negativo apresentaram cultura negativa (Tabela 1).
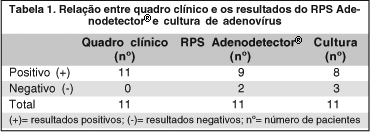

O RPS Adenodetector® mostrou sensibilidade de 100% (intervalo de confiança [IC] de 95%: 63%-100%) e especificidade de 67% (IC de 95%: 9%-99%). Os resultados do RPS Adenodetector® e da cultura concordaram em 10 (91%) dos 11 pacientes examinados (teste Kappa: 0,74; p=0,01).
DISCUSSÃO
O diagnóstico preciso de um caso de conjuntivite altamente contagiante como a adenoviral é importante no intuito de se evitar propagação da doença, em especial em instituições como creches, hospitais, clínicas e escolas(10). O melhor método diagnóstico para qualquer doença infecciosa é aquele com alta sensibilidade e especificidade, rápido na realização e no resultado, que não necessite pessoal com treinamento especializado e com baixo custo(10).
O isolamento viral através da cultura de células requer a presença de organismos viáveis e um meio de cultura específico para o transporte rápido ao laboratório. Apesar de ser necessário mais tempo para o resultado quando comparado com outros métodos e do custo na sua realização, a cultura de células permanece como o padrão-ouro no diagnóstico de conjuntivite viral, pois o isolamento do agente infeccioso é definitivo(11).
Dentre os testes de diagnósticos rápidos disponíveis para detecção de adenovírus temos o Adenoclone® teste, SAS Adenotest® e mais recentemente o RPS Adenodetector®. A literatura também apresenta a Reação em cadeia da polimerase (PCR) como alternativa de teste rápido(12), inclusive no Brasil(13), apesar do alto custo da metodologia.
O Adenoclone® teste(14) e o SAS Adenotest® teste(15) mostraram sensibilidade (54,7% e 50,5%) e especificidade (97,1% e 100%, respectivamente) similares, mas os limites de detecção variaram. O SAS Adenotest® foi capaz de detectar vírus 13 dias após o início dos sintomas enquanto o Adenoclone® teste foi limitado a 11 dias.
O RPS Adenodetector® apresenta em geral sensibilidade de 85% e especificidade de 95%(16-17). No presente estudo, utilizando a cultura de células como padrão-ouro no diagnóstico de ceratoconjuntivite adenoviral, o RPS Adenodetector® mostrou sensibilidade de 100% e especificidade de 67% com um intervalo de confiança largo (9%-99%) devido à amostra reduzida.
Em recente estudo com 186 pacientes, Sambursky et al. encontraram sensibilidade do RPS Adenodetector® de 88% e especificidade de 91%(18).
Dentre as grandes vantagens do RPS Adenodetector® está a rapidez e facilidade na realização do teste, possibilitando com isso o diagnóstico etiológico da conjuntivite aguda e melhor orientação terapêutica e profilática, em relação ao contágio, bem como a economia de uso de medicamentos desnecessários. Dentre as desvantagens, está o aumento nos custos para o diagnóstico de conjuntivite adenoviral.
O estudo apresenta como limitações, o pequeno número da amostra e a ausência de um grupo controle sem o quadro clínico de conjuntivite adenoviral. Novos estudos com um maior número de pacientes, seriam importantes para uma melhor avaliação deste teste.
CONCLUSÃO
O RPS Adenodetector® foi útil como método para o diagnóstico de conjuntivite adenoviral, sem necessidade de pessoal altamente qualificado para sua realização. O teste, pela sua rapidez, pode ser importante no controle da disseminação da infecção.
AGRADECIMENTO
Os autores agradecem a avaliação estatística realizada pelo Dr. Luiz Alberto Mello.
REFERÊNCIAS
1. Butt AL, Chodosh J. Adenoviral keratoconjunctivitis in a tertiary care eye clinic. Cornea. 2006;25(2):199-202.
2. Tanaka K, Itoh N, Saitoh-Inagawa W, Uchio E, Takeuchi S, Aoki K, et al. Genetic characterization of adenovirus strains isolated from patients with acute conjunctivitis in the city of Sao Paulo, Brazil. J Med Virol. 2000;61(1):143-9.
3. Costa LF, Yokosawa J, Mantese OC, Oliveira TF, Silveira HL, Nepomuceno LL, et al. Respiratory viruses in children younger than five years old with acute respiratory disease from 2001 to 2004 in Uberlandia, MG, Brazil. Mem Inst Oswaldo Cruz. 2006;101(3):301-6.
4. Ison MG. Adenovirus infections in transplant recipients. Clin Infect Dis. 2006; 43(3):331-9.
5. Stefkovicova M, Sokolik J, Vicianova V, Madar R. Outbreaks of epidemic kerato-conjunctivitis in two hospital wards. Cent Eur J Public Health. 2005;13(1): 29-31.
6. Freitas D, Belfort Júnior R. Conjuntivites. Arq Bras Oftalmol. 1992;55(5): 196-205.
7. Uchio E, Ishiko H, Aoki K, Ohno S. Adenovirus detected by polymerase chain reaction in multidose eyedrop bottles used by patients with adenoviral keratoconjunctivitis. Am J Ophthalmol. 2002;134(4):618-9.
8. Uchio E, Matsuura N, Takeuchi S, Itoh N, Ishiko H, Aoki K, Ohno S. Acute follicular conjunctivitis caused by adenovirus type 34. Am J Ophthalmol. 1999;128(6):680-6.
9. Alvarenga L, Scarpi M, Mannis M. Viral conjunctivitis. In: Krachmer JH, Mannis MJ, Holland EJ. Cornea. St. Louis: Mosby; 2005. p.629-38.
10. Percivalle E, Sarasini A, Torsellini M, Bruschi L, Antoniazzi E, Grazia Revello M, Gerna G. A comparison of methods for detecting adenovirus type 8 keratoconjunctivitis during a nosocomial outbreak in a Neonatal Intensive Care Unit. J Clin Virol. 2003;28(3):257-64.
11. Krisher KK, Menegus MA. Evaluation of three types of cell culture for recovery of adenovirus from clinical specimens. J Clin Microbiol. 1987;25(7): 1323-4.
12. Koidl C, Bozic M, Mossbock G, Muhlbauer G, Berg J, Stocher M, et al. Rapid diagnosis of adenoviral keratoconjunctivitis by a fully automated molecular assay. Ophthalmology. 2005;112(9):1521-8.
13. Mendes RM, Nogueira ML, Marques JT, Pereira MVC, Machado MAS, et al. A rapid polymerase chain reaction protocol to detect adenovirus in eye swabs. Arq Bras Oftalmol. 2004,67(3):423-7.
14. Wiley LA, Roba LA, Kowalski RP, Romanowski EG, Gordon YJ. A 5-year evaluation of the adenoclone test for the rapid diagnosis of adenovirus from conjunctival swabs. Cornea. 1996;15(4):363-7.
15. Mielke J, Grub M, Freudenthaler N, Deuter CM, Beck R, Zierhut M. [Epidemic keratoconjunctivitis. Detecting adenoviruses]. Ophthalmologe. 2005;102 (10):968-70. German.
16. Uchio E, Aoki K, Saitoh W, Itoh N, Ohno S. Rapid diagnosis of adenoviral conjunctivitis on conjunctival swabs by 10-minute immunochromatography. Ophthalmology. 1997;104(8):1294-9.
17. Kozich K, Seitz B, Cursiefen C, Sambursky R, Tauber S. Rapid detection of conjunctival adenovirus infection by immunochromatography. In: Association of Research in Vision and Ophthalmology (ARVO), 2005, Fort Lauderdale, Flórida.
18. Sambursky R, Tauber S, Schirra F, Kozich K, Davidson R, Cohen EJ. The RPS adeno detector for diagnosing adenoviral conjunctivitis. Ophthalmology. 2006;113(10):1758-64.
Endereço para correspondência:
Rubens Belfort Jr.
Rua Botucatu, 822
São Paulo (SP) CEP 04023-062
E-mail: [email protected]
Recebido para publicação em 16.10.2006
Última versão recebida em 17.02.2007
Aprovação em 19.03.2007
Nota Editorial: Depois de concluída a análise do artigo sob sigilo editorial e com a anuência do Dr. José Augusto Alves Ottaiano sobre a divulgação de seu nome como revisor, agradecemos sua participação neste processo.
Protocolo de estudo aprovado pelo Comitê de Ética em Pesquisa da UNIFESP/Escola Paulista de Medicina.
Trabalho realizado no Departamento de Oftalmologia da Universidade Federal de São Paulo - UNIFESP e Seção de Vírus Respiratórios, Instituto Adolfo Lutz, Secretaria do Estado da Saúde de São Paulo.