

Gustavo Barreto de Melo1; José Álvaro Pereira Gomes2; Maria Aparecida da Glória3; Maria Cristina Martins4; Edna Freymüller Haapalainen5
DOI: 10.1590/S0004-27492007000300005
RESUMO
OBJETIVO: Avaliar as características morfológicas da membrana amniótica desepitelizada por diferentes técnicas. MÉTODOS: A membrana amniótica humana foi coletada no momento do parto, fixada em concentrações crescentes de glicerol (0-50% em DMEM) e preservada a 80°C até a hora de ser usada. O estudo consistiu de 4 grupos: epitélio intacto (controle) e membranas desepitelizadas pela tripsina (2 mg/mL a 1:250), dispase (1,2 U/mL em solução salina balanceada de Hank livre de Mg2+ e Ca2+) e ácido etilenodiaminotetra-acético (EDTA), 0,02%). As amostras foram submetidas à análise por microscopia eletrônica (de varredura e de transmissão). RESULTADOS: A microscopia eletrônica de varredura mostrou epitélio intacto no grupo controle e sua ausência nas membranas amnióticas desepitelizadas pela tripsina e pela dispase. Naquelas tratadas com o ácido etilenodiaminotetra-acético, havia áreas com e sem epitélio. Quando avaliadas pela microscopia eletrônica de transmissão, o epitélio estava intacto e firmemente aderido à membrana basal através de hemidesmossomos nos grupos controle e em parte do ácido etilenodiaminotetra-acético. Havia apenas fibras colágenas nas membranas tratadas com dispase e tripsina. CONCLUSÕES: O tratamento da membrana amniótica com tripsina e dispase pode causar completa retirada do epitélio e da membrana basal, ao passo que o ácido etileno- diaminotetra-acético pode preservar áreas com epitélio intacto e parcialmente destruir a membrana basal em outras.
Descritores: Âmnio; Ácido edético; Doenças da córnea; Tripsina; Endopeptidases; Microscopia eletrônica
ABSTRACT
PURPOSE: To evaluate the morphological features of the amniotic membrane denuded by different techniques. METHODS: Human amniotic membrane was collected at the time of delivery, fixed in increasing concentrations of glycerol (0-50% in DMEM) and preserved at -80ºC until the time of use. The study consisted of 4 groups: intact epithelium (control) and denuded by trypsin (2 mg/mL at 1:250), dispase (1.2 U/mL in Mg2+ and Ca2+ free Hank's balanced salt solution) or ethylenediaminetetraacetic acid (EDTA), 0.02%. Specimens were submitted to electron (scanning and transmission) microscopy analysis. RESULTS: Scanning electron microscopy disclosed intact epithelium in the control group and its absence in the amniotic membranes denuded by trypsin and dispase. In those denuded by ethylenediaminetetraacetic acid there were areas with and without epithelium. When assessed by transmission electron microscopy, the epithelium was intact and firmly adhered to the basement membrane by hemidesmossomes in controls and in parts of ethylenediaminetetraacetic acid group. There were only collagen fibers in the dispase- and trypsin-treated groups. CONCLUSIONS: Trypsin and dispase treatment of the amniotic membrane may cause complete denuding of the epithelium and basement membrane whereas ethylenediaminetetraacetic acid may leave some intact epithelium-areas and partially destroy the basement membrane in others.
Keywords: Amnion; Edetic acid; Corneal diseases; Trypsin; Endopeptidases; Microscopy; electron
INTRODUÇÃO
A membrana amniótica vem sendo rotineiramente utilizada em oftalmologia no tratamento de afecções da superfície ocular. Sua utilização baseia-se na capacidade de beneficiar o processo de epitelização, além de reduzir os processos inflamatórios, angiogênicos e cicatriciais(1). As principais indicações do uso de membrana amniótica são: defeitos corneanos persistentes ou recorrentes(2-3), perfurações corneanas(3-5), reconstruções conjuntivais(6) como enxerto após a remoção cirúrgica de pterígio e tumores(6) simbléfaros severos(7), como oclusor de pontos lacrimais em casos de olho seco(3), no tratamento de bolhas filtrantes com vazamentos(5) e nas reconstruções palpebrais(8).
Em um modelo experimental de deficiência total de limbo em olhos de coelhos, foi observado que 77% dos animais que foram submetidos ao transplante de membrana amniótica apresentaram recuperação total ou parcial da superfície ocular(9). O grupo controle, que não recebeu membrana amniótica, desenvolveu vascularização e opacidade corneanas em 100% dos casos. Esses excelentes resultados podem ser explicados pelas características inatas da membrana amniótica, que possui uma membrana basal espessa e propriedades antiinflamatórias, antiapoptóticas e inibitórias da cicatrização, provavelmente relacionadas à presença e/ou inibição de fatores de crescimento(7,9-11).
Em 1998 alguns autores estudaram o transplante de membrana amniótica em 31 olhos de 26 pacientes com deficiência limbar leve, moderada e severa(11). A epitelização completa ocorreu em 93,5% dos pacientes (2 a 4 semanas, sendo que 83% dos pacientes apresentaram melhora da acuidade visual). Em 1999 outros autores relataram os resultados a longo prazo (3 anos) do uso de transplante de células germinativas límbicas e membrana amniótica no tratamento de casos severos de ceratoconjuntivites cicatriciais(12). Esses autores observaram epitelização corneana em 51% dos casos e melhora da acuidade visual em 60% dos casos, resultados animadores para casos graves de doenças da superfície ocular que até então apresentavam prognóstico sombrio.
A membrana amniótica tem sido utilizada como substrato para proliferação in vitro de células-tronco do limbo, conhecida como cultura ex vivo. Posteriormente, a membrana amniótica é transplantada para o olho e as células cultivadas se diferenciam no epitélio corneano. Para conseguir isso, diferentes protocolos têm sido tentados usando células derivadas de explante de tecido límbico(13-15) ou suspensão de células epiteliais, com ou sem prévia expansão em camada nutridora de fibroblasto 3T3(16-17).
Não é bem conhecido, precisamente, se o substrato ideal para expansão ex vivo das células-tronco do epitélio corneano para reconstrução da superfície ocular seria obtido a partir de membrana com ou sem seu epitélio. Alguns trabalhos mostraram os potenciais benefícios da membrana intacta enquanto outros mostram melhores resultados com a membrana desepitelizada(14-17). A desepitelização pode ser conseguida utilizando-se dispase, tripsina ou ácido etilenodiaminotetra-acético (EDTA). No entanto, não há trabalhos mostrando as diferenças microscópicas na membrana nesses métodos. Portanto, o objetivo deste estudo foi investigar as características morfológicas da membrana amniótica desepitelizada por diferentes processos químicos.
MÉTODOS
1. Obtenção e preparação da membrana amniótica
A obtenção e o processamento da membrana amniótica foram realizados de acordo com as normas do protocolo aprovado pela Comissão de Ética da UNIFESP/EPM. Essas normas baseiam-se no protocolo proposto por alguns autores(9), seguindo as premissas impostas pela United States Food and Drug Administration (FDA) e The American Association of Tissue Banking (AATB).
A membrana amniótica foi obtida a partir das placentas provenientes de cesáreas eletivas de pacientes do Departamento de Obstetrícia e Ginecologia da UNIFESP e Hospital Maternidade São Luiz, após consentimento assinado pelas gestantes. Todas essas pacientes tiveram exames sorológicos negativos para HIV-1, Hepatite B (HBsAg) e sífilis (VDRL), que foram re-confirmados pela realização de sorologia do sangue do cordão umbilical após o parto. Após 6 meses, a doadora foi submetida a novos testes sorológicos para excluir o risco de infecção por HIV.
Após a obtenção da placenta no centro cirúrgico obstétrico, procedeu-se a sua lavagem com o uso de soro fisiológico 0,9% em ambiente estéril. Posteriormente, o âmnio foi separado do córion com a utilização de tesoura e pinça estéreis e estendido sobre um filtro de nitrocelulose estéril (Millipore, Bedfort, MA, EUA) com a face epitelial para cima. A membrana e o filtro foram lavados com solução tampão fosfato contendo 1.000 U/mL de penicilina, 20 mcg/mL de estreptomicina e 2,5 mcg/mL de anfotericina B (Ophthalmos, São Paulo), cortados em fragmentos de aproximadamente 3x3 cm, colocados em um recipiente estéril contendo glicerol (Baxter Healthcare Corporation, Stolle Mountain, GA, EUA) e meio de preservação de córnea (Ophthalmos, São Paulo) na proporção de 1:1 e congelados a - 80°C. Amostras de cada membrana obtida foram enviadas para estudo histopatológico e microbiológico (bacterioscopia e cultura). O tempo máximo para utilização das membranas foi de 3 meses após a congelação(1).
Foram coletados 8 fragmentos, medindo cerca de 3x3 cm, da membrana amniótica. Estes foram divididos em 4 grupos:
• Grupo controle: não foi feita desepitelização da membrana.
• Grupo dispase: a membrana foi desepitelizada pela dispase (1,2 U/mL em Mg2+- e solução salina Hank livre de Ca2+) por 15 a 30 minutos, seguida por fricção mecânica para remover as células epiteliais amnióticas.
• Grupo tripsina: a membrana foi desepitelizada pela tripsina (2 mg/mL a 1:250) a 37°C por 30 minutos, seguida por fricção mecânica para remover as células epiteliais amnióticas.
• Grupo EDTA: a membrana foi desepitelizada pelo ácido etilenodiaminotetra-acético 0,02% (EDTA) a 37°C por 2 horas, seguida por fricção mecânica para remover as células epiteliais amnióticas.
Todas as amostras foram divididas ao meio e enviadas tanto para microscopia eletrônica de varredura quanto de transmissão.
2. Microscopia eletrônica de transmissão (MET)
A membrana amniótica foi lavada em tampão cacodilato, (0,2 M, pH 7) para retirar o meio de preservação e foi colocada em fixador Karnovsky modificado (paraformaldeído 2%, glutaraldeído 2,5%, CaCb 25 mg/ml) (Sigma Chemical, St. Louis, MO, EUA) por 24h, a 4°C. Após desprezar o fixador, o tecido foi deixado em tampão cacodilato (EM Sciences, Philadelphia, PA, EUA) por 24h a 4°C. Iniciou-se inclusão colocando o tecido em solução de ósmio a 2% (EM Sciences, Philadelphia, PA, EUA) por 1h em temperatura ambiente. O tecido foi lavado 2 vezes por 1 minuto, em água bidestilada e colocado em solução de acetato de uranila (uranila 0,5% e sacarose 13,3%) (EM Sciences, Philadelphia, PA, EUA) por 30 minutos. Após 2 lavagens em água bidestilada, o tecido foi desidratado em etanol 70% por 30 minutos, etanol 90% por 30 minutos e etanol 100% por 40 minutos. Colocou-se o tecido em óxido de propileno (EM Sciences, Philadelphia, PA, EUA) por 40 minutos, e, depois, em uma mistura de 2 partes de óxido de propileno para 1 parte de resina Araldite (EM Sciences, Philadelphia, PA, EUA) por 4 horas em agitador orbital. A resina foi desprezada e colocada no tecido na mistura de 1 parte de óxido de propileno para 1 parte de Araldite, que foi deixado sem tampa, por 16 às 18h, em agitador orbital. O tubo contendo tecido foi transferido em resina para câmara de vácuo por 4 a 5 horas e, depois, colocou-se cada peça do tecido em blocos próprios para MET. Cada peça de tecido foi deixada polimerizar a 60°C por 48 horas e foi seccionada em cortes finos (0,3 a 0,5 µm) e ultrafinos (70 a 90 nm) para observação microscópica.
3. Microscopia eletrônica de varredura (MEV)
O tecido foi lavado em tampão cacodilatado (0,2M, pH 7) para retirar o meio de preservação e foi colocado em fixador Karnovsky modificado (paraformaldeído 2%, glutaraldeído 2,5%, CaCl 25 mg/ml) por 24 horas a 4°C. Desprezou-se o fixador e o tecido foi deixado em tampão cacodilatado por 24 horas a 4°C. Iniciou-se inclusão colocando o tecido em solução de ósmio a 1% por 1 hora em temperatura ambiente. O tecido foi lavado por 30 minutos (3 trocas de 10 minutos cada) em tampão cacodilatado 0,1M e colocado em solução de ácido tânico a 1% por 30 minutos. Após 2 lavagens com água bidestilada, colocou-se o tecido em solução de ósmio a 1% por 30 minutos. O tecido foi lavado em água bidestilada por 15 minutos e desidratado em concentrações crescentes de etanol (50, 70, 90 e 100%, 20 minutos cada). Com o material em etanol a 100%, foi colocado em aparelho de ponto crítico (Balzers, modelo CPD-030). O material foi transferido para o "stub" metálico e submetido ao processo de metalização com ouro (aparelho de "sputtering", Balzers, modelo SCD-050). Posteriormente, foi feita a análise por microscopia eletrônica de varredura.
RESULTADOS
As imagens da microscopia eletrônica podem ser vistas nas figuras 1 a 4. A microscopia eletrônica de varredura mostrou um epitélio intacto no grupo controle e sua ausência nas membranas amnióticas desepitelizadas pela tripsina e pela dispase. Naquelas tratadas com o EDTA, havia áreas com e sem epitélio.
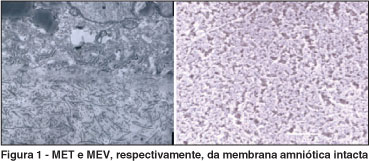
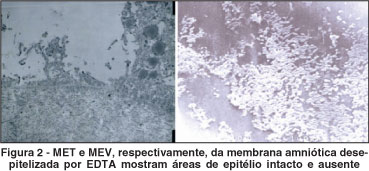

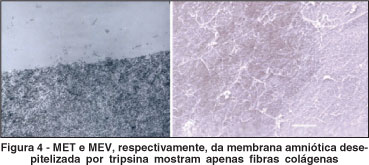
Quando avaliadas pela microscopia eletrônica de transmissão, o epitélio estava intacto e firmemente aderido à membrana basal através de hemidesmossomos nos controles. Havia apenas fibras colágenas nas membranas tratadas com dispase e tripsina. O EDTA causou pobre desepitelização (mantendo hemidesmossomos). Em algumas áreas, não só o epitélio como também a membrana basal foram extraídos.
DISCUSSÃO
A membrana amniótica possui espessura que varia de 0,02 a 0,5 mm. É composta por uma camada única de células epiteliais colunares, que se tornam cubóides e mais planas no âmnio extra-placentário. Essas células repousam sobre uma membrana basal composta principalmente de colágeno do tipo IV e VII, laminina e fibronectina(18). O mesênquima subjacente consiste de matriz composta principalmente de colágeno do tipo I, III e V, entremeada por células tipo fibroblasto.
As células epiteliais amnióticas são aderidas umas às outras por numerosos desmossomos. Sua superfície basal apresenta dobras, que se interdigitam com a lâmina basal, a qual é fixada por numerosos hemidesmossomos(19).
Foi mostrado que as células epiteliais da membrana amniótica produzem neurotransmissores, neuropeptídeos, fatores neurotróficos e fator de crescimento derivado do pigmento (PEDF). Todos esses podem promover o crescimento e funcionamento das células epiteliais corneanas em meio de cultura(20-22). Além disso, foi demonstrado que as células-tronco epiteliais cultivadas na membrana amniótica com epitélio íntegro se tornam menos diferenciadas e retêm sua função por um período mais longo(23-24).
No entanto, também foi demonstrado que resultados melhores podem ser obtidos com a forma desepitelizada(25). De fato, a desepitelização da membrana com EDTA num outro estudo manteve íntegras a membrana basal e a lâmina densa. Estas, por sua composição semelhante à da porção apical da camada de Bowman corneana, mostraram-se fundamentais para a adequada adesão das células-tronco corneana(26). Portanto, a preservação da membrana basal e da lâmina densa tem se mostrado essencial para a expansão ex vivo das células-tronco corneanas. Apesar da amostragem limitada, essas características da membrana amniótica não foram obtidas neste trabalho quando realizada a desepitelização com dispase e tripsina. Talvez fosse necessário menor tempo de exposição a essas substâncias. Quanto ao EDTA, na concentração e no tempo usados, mostrou-se incapaz de remover completamente o epitélio. A adição de maior debridamento mecânico poderia ser realizado a fim de remover as áreas de epitélio remanescentes. Diferentemente das outras técnicas, o EDTA, mesmo destruindo algumas áreas, preservou melhor a membrana basal da membrana amniótica.
CONCLUSÕES
Em conclusão, o tratamento da membrana amniótica com tripsina e dispase pode causar completa retirada do epitélio e da membrana basal, enquanto o EDTA pode preservar áreas com epitélio intacto e parcialmente destruir a membrana basal em outras.
REFERÊNCIAS
01. Gomes JA, Komagome CM, Santos N, Cunha MC, Freitas D. Membrana amniótica nas cirurgias reconstrutivas da superfície ocular nas ceratoconjuntivites cicatriciais. Arq Bras Oftalmol. 1999;62(5):562-76.
02. Dua HS, Azuara-Blanco A. Amniotic membrane transplantation. Br J Ophthalmol. 1999;83(6):748-52.
03. Chen HJ, Pires RT, Tseng SC. Amniotic membrane transplantation for severe neurotrophic corneal ulcers. Br J Ophthalmol. 2000;84(8):826-33.
04. Dua HS, Gomes JA, King AJ, Maharajan VS. The amniotic membrane in ophthalmology. Surv Ophthalmol. 2004;49(1):51-77.
05. Meller D, Tseng SC. [Amniotic membrane transplantation with or without limbal allografts in corneal surface reconstruction in limbal deficiency]. Ophthalmologe. 2000;97(2):100-7. German.
06. Prabhasawat P, Barton K, Burkett G, Tseng SC. Comparison of conjunctival autografts, amniotic membrane grafts, and primary closure for pterygium excision. Ophthalmology. 1997;104(6):974-85.
07. Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br J Ophthalmol. 1998;82(3):235-40.
08. Tseng SC, Prabhasawat P, Lee SH. Amniotic membrane transplantation for conjunctival surface reconstruction. Am J Ophthalmol. 1997;124(6):765-74.
09. Kim JC, Tseng SC. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas. Cornea. 1995; 14(5):473-84.
10. Tsubota K, Satake Y, Ohyama M, Toda I, Takano Y, Ono M, et al. Surgical reconstruction of the ocular surface in advanced ocular cicatricial pemphigoid and Stevens-Johnson syndrome. Am J Ophthalmol. 1996;122(1):38-52. Comment in: Am J Ophthalmol. 1996;122(6):914-5. Am J Ophthalmol. 1996;122(5):752-3.
11. Tseng SC, Prabhasawat P, Barton K, Gray T, Meller D. Amniotic membrane transplantation with or without limbal allografts for corneal surface reconstruction in patients with limbal stem cell deficiency. Arch Ophthalmol. 1998; 116(4):431-41.
12. Tsubota K, Goto E, Fujita H, Ono M, Inoue H, Saito I, et al. Treatment of dry eye by autologous serum application in Sjogren's syndrome. Br J Ophthalmol. 1999;83(4):390-5. Comment in: Br J Ophthalmol. 1999;83(4):384-5.
13. Koizumi N, Inatomi T, Quantock AJ, Fullwood NJ, Dota A, Kinoshita S. Amniotic membrane as a substrate for cultivating limbal corneal epithelial cells for autologous transplantation in rabbits. Cornea. 2000;19(1):65-71.
14. Meller D, Pires RT, Tseng SC. Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane cultures. Br J Ophthalmol. 2002;86(4):463-71.
15. Grueterich M, Tseng SC. Human limbal progenitor cells expanded on intact amniotic membrane. Arch Ophthalmol. 2002;120(6):783-90.
16. Schwab IR. Cultured corneal epithelia for ocular surface disease. Trans Am Ophthalmol Soc. 1999;97:891-986.
17. Koizumi N, Cooper LJ, Fullwood NJ, Nakamura T, Inoki K, Tsuzuki M, et al. An evaluation of cultivated corneal limbal epithelial cells, using cell-suspension culture. Invest Ophthalmol Vis Sci. 2002;43(7):2114-21.
18. Linnala A, Von Koskull H, Virtanen I. Isoforms of cellular fibronectin and tenascin in amniotic fluid. FEBS Lett. 1994;337(2):167-70.
19. Van Herendael BJ, Oberti C, Brosens I. Microanatomy of the human amniotic membranes. A light microscopic, transmission, and scanning electron microscopic study. Am J Obstet Gynecol. 1978;131(8):872-80.
20. Touhami A, Grueterich M, Tseng SC. The role of NGF signaling in human limbal epithelium expanded by amniotic membrane culture. Invest Ophthalmol Vis Sci. 2002;43(4):987-94.
21. Uchida S, Inanaga Y, Kobayashi M, Hurukawa S, Araie M, Sakuragawa N. Neurotrophic function of conditioned medium from human amniotic epithelial cells. J Neurosci Res. 2000;62(4):585-90.
22. Shao C, Sima J, Zhang SX, Jin J, Reinach P, Wang Z, et al. Suppression of corneal neovascularization by PEDF release from human amniotic membranes. Invest Ophthalmol Vis Sci. 2004;45(6):1758-62.
23. Grueterich M, Espana E, Tseng SC. Connexin 43 expression and proliferation of human limbal epithelium on intact and denuded amniotic membrane. Invest Ophthalmol Vis Sci. 2002;43(1):63-71.
24. Grueterich M, Espana EM, Tseng SC. Ex vivo expansion of limbal epithelial stem cells: amniotic membrane serving as a stem cell niche. Surv Ophthalmol. 2003;48(6):631-46.
25. Koizumi N, Fullwood NJ, Bairaktaris G, Inatomi T, Kinoshita S, Quantock AJ. Cultivation of corneal epithelial cells on intact and denuded human amniotic membrane. Invest Ophthalmol Vis Sci. 2002;41(9):2506-13.
26. Cooper LJ, Kinoshita S, German M, Koizumi N, Nakamura T, Fullwood NJ. An investigation into the composition of amniotic membrane used for ocular surface reconstruction. Córnea. 2005;24(6):722-9.
Endereço para correspondência:
Gustavo Barreto de Melo
Rua Sabará, 16 - Apto. 113
São Paulo (SP) CEP 01239-010
E-mail: [email protected]
Recebido para publicação em 10.11.2006
Última versão recebida em 21.02.2007
Aprovação em 22.02.2007
Estudo realizado com auxílio financeiro da FAPESP.
Nota Editorial: Depois de concluída a análise do artigo sob sigilo editorial e com a anuência da Dra. Hélia Soares Angotti sobre a divulgação de seu nome como revisora, agradecemos sua participação neste processo.
Trabalho realizado no Departamento de Oftalmologia da Universidade Federal de São Paulo - Escola Paulista de Medicina - UNIFESP/EPM.