

Gustavo Victor1; Milton Ruiz Alves2; Walton Nosé3
DOI: 10.1590/S0004-27492007000100009
RESUMO
OBJETIVO: Descrever os achados da microscopia confocal in vivo em pacientes nos diversos estágios de ceratopatia induzida por amiodarona, e correlacionar o estadiamento biomicroscópico com o estadiamento confocal. MÉTODOS: Vinte olhos de 10 pacientes (6 homens e 4 mulheres) em tratamento com amiodarona, que apresentavam ceratopatia induzida pela droga, foram selecionados para o estudo, com a microscopia confocal (MC). RESULTADOS: A média de idade foi 58 ± 6,2 anos (50-66 anos) e o tempo de uso da droga foi de 6 ± 3,2 anos (2-11 anos). Todos pacientes tinham acuidade visual com correção melhor ou igual a 20/40. A biomicroscopia evidenciou ceratopatia por amiodarona: dois pacientes no estágio 1, quatro no estágio 2 e quatro no estágio 3. Todas as córneas apresentaram inclusões intracelulares brilhantes e de alta refletividade na camada epitelial basal. A partir dos estágios 2 e 3, foram encontrados microdepósitos em todas camadas corneanas. Foram observados afilamento e aumento da tortuosidade dos nervos corneanos nos estágios 2 e 3 da ceratopatia. A contagem endotelial média foi de 2.524 ± 150,3 células/mm². CONCLUSÃO: O epitélio basal foi o mais acometido nos diferentes estágios da ceratopatia. Nos pacientes do estágio 1 a biomicroscopia, os microdepósitos subepiteliais são restritos ao epitélio superficial e basal, ao passo que nos pacientes dos estágios 2 e 3, os microdepósitos afetam todas camadas corneanas. À medida que a ceratopatia avança, os nervos corneanos ficam mais afilados e tortuosos.
Descritores: Doenças da córnea; Epitélio; Amiodarona; Microscopia confocal
ABSTRACT
PURPOSE: To describe in vivo confocal microscopy findings in patients with different stages of amiodarone-induced keratopathy, and correlate biomicroscopy stages with confocal stages. METHODS: Twenty eyes of 10 patients (6 men and 4 women), who receive treatment with amiodarone were selected for the study with confocal microscopy (MC). RESULTS: The average age was 58 ± 6.2 years (50-66 years) and time of use of the drug was 6 ± 3.2 years (2-11 years). All patients have best correct visual acuity ³ 20/40. There were two patients in stage 1, 4 patients in stage 2 and 4 in stage 3 of induced keratopathy. All corneas presented brilliant intracellular inclusions with high reflectivity in the basal epithelium layer. Patients in stage 2 and 3 have all corneal layers affected. There are thinning and increase of tortuosity of corneal nerves in patients in stage 2 and 3. The endothelial count was 2,524 ± 150,3 cell/mm². CONCLUSION: The basal epithelium was most affected in any of the keratopathy stages. In stage 1 patients only the superficial and basal epithelium are affected, while patients in stages 2 and 3 have all corneal layers affected. With the advance of keratophaty the corneal nerves became thinner and tortuous.
Keywords: Corneal diseases; Epithelium; Amiodarone; Microscopy, confocal
INTRODUÇÃO
Várias drogas de uso sistêmico ou tópico (ocular) podem causar depósitos corneanos. A amiodarona, um antiarrítmico efetivo no controle de arritmias ventriculares e supraventriculares têm muitos efeitos colaterais documentados como: descoloração da pele, aumento da sensibilidade à luz, hepatite, disfunção tireoideana, fibrose pulmonar, supressão da medula óssea e depósitos corneanos(1). Outros efeitos colaterais oculares relacionados ao nervo óptico, retina, cristalino e pálpebras têm sido descritos(2). A ceratopatia induzida por amiodarona foi primeiramente descrita em 1968(3), e definida como depósitos marrom-dourados, arranjados linearmente em formato arboriforme ou de flores (whorl-shaped). Os microdepósitos corneanos são o achado mais comum nos pacientes tratados com amiodarona(2) e, geralmente, são bilaterais e simétricos(4-5). Estes depósitos não alteram a acuidade visual e geralmente desaparecem após 3 a 20 meses de descontinuação da droga(6-7). A prevalência desta ceratopatia varia entre 70 e 100%(2), mas apenas 10% dos pacientes reclamam de sintomas(8), como halos coloridos ao redor de luzes em ambientes escuros, quando a pupila está em midríase. O estadiamento, baseado na disposição dos microdepósitos, observável à biomicroscopia, é comumente usado para descrever o grau de comprometimento(9-11). Estes microdepósitos foram estudados com microscopia eletrônica, que revelou inclusões intracitoplasmáticas "lysossomo-like", confinado nas células epiteliais basais, anteriormente à camada de Bowman(12).
A microscopia confocal (MC) é uma importante ferramenta no estudo histológico corneano permitindo o estudo de todas as camadas corneanas in vivo. O objetivo deste estudo é descrever os achados da microscopia confocal in vivo em pacientes nos diversos estágios de ceratopatia induzida por amiodarona, assim como correlacionar o estadiamento biomicroscópico com o estadiamento confocal(13-20).
MÉTODOS
Vinte olhos de 10 pacientes (6 homens e 4 mulheres) em tratamento com amiodarona, que apresentavam ceratopatia induzida pela droga, foram selecionados para o estudo. Os pacientes não tinham história de doença ou cirurgia ocular prévia e não utilizavam outra droga além da amiodarona. Os pacientes realizaram exame oftalmológico completo e MC. O aparelho utilizado foi o ConfoScan 2 (Nidek®, EUA), que possibilita o estudo in vivo das camadas corneanas(13-20). Na classificação biomicroscópica(9-11), o primeiro estágio corresponde a uma coalescência de microdepósitos acinzentados ou marrom-dourados no epitélio basal, dispostos horizontalmente na região inferior da córnea. O segundo estágio, uma arborização adicional e linhas horizontais lembram os fios ou barba de gato. O terceiro estágio é caracterizado pela extensão das lesões assumindo um padrão verticillata "whorl-like", que pode envolver o eixo visual.
RESULTADOS
Achados clínicos
A média de idade foi 58 ± 6,2 anos (50-66 anos) e o tempo de uso da droga foi de 6 ± 3,2 anos (2-11 anos). A dose variou de 100 a 600 mg por dia. Todos pacientes tinham acuidade visual logMAR com a correção melhor ou igual a 0.30. A pressão intra-ocular média foi de 15 ± 3,2 mmHg. O exame fundoscópico não mostrou evidências de maculopatia em nenhum dos casos. A biomicroscopia evidenciou ceratopatia por amiodarona: dois pacientes no estágio 1, quatro no estágio 2 e quatro no estágio 3 (Figura 1). Apenas um paciente (estágio 3) referiu sintomas: halos, às vezes coloridos, à noite.
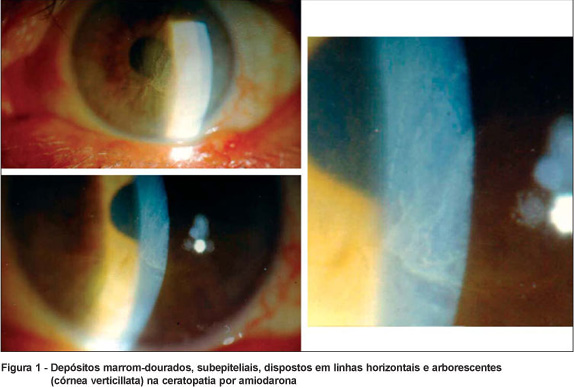
Achados com microscópio confocal
Nos pacientes no estágio 1:
O epitélio basal foi o mais afetado (Figura 2). Nesta região, os depósitos caracterizaram-se como inclusões arredondadas, de bordas definidas, brilhantes e de alta refletividade, com diâmetros entre 2 e 15 µm de diâmetro. O epitélio superficial apresentou-se de morfologia normal, com áreas de maior refletividade no núcleo e na membrana celular de algumas células (Figura 2). O plexo nervoso subepitelial e assim como os nervos penetrantes do estroma anterior apresentaram-se sem alterações. Da camada de Bowman ao endotélio não foram observadas alterações.
Nos pacientes do estágio 2:
Os achados microscópicos in vivo no epitélio superficial e basal nos pacientes deste estágio são semelhantes ao do estágio 1. A região da córnea mais afetada foi o epitélio basal. Neste estágio de ceratopatia, foi observado que os microdepósitos se encontravam também na camada de Bowman, circundando o plexo nervoso subepitelial, (Figura 3) e no estroma anterior (Figura 4), transpondo a camada de Bowman. Os nervos do plexo nervoso subepitelial mostraram-se mais tortuosos. No estroma, os microdepósitos se apresentaram com formatos mais irregulares, bordas menos definidas que no epitélio, brilhantes com alta refletividade e medindo entre 2 e 32 µm de diâmetro. Nesta região, os microdepósitos estão mais afastados uns dos outros, levando a uma menor densidade de depósitos que no epitélio basal (Figura 4). Foram observados microdepósitos ao redor dos nervos penetrantes no estroma anterior, e afilamento destas estruturas (Figura 5). Nos pacientes em estágio 2 mais avançados, foram observados microdepósitos em todo estroma, com densidade decrescente, e algumas células endoteliais afetadas (Figura 4).

Nos pacientes do estágio 3:
Neste estágio, a região corneana mais afetada também foi o epitélio basal. Os achados no epitélio superficial, epitélio basal, camada de Bowman, plexo nervoso subepitelial, estroma, nervos penetrantes no estroma anterior e endotélio foram semelhantes aos encontrados nos pacientes no estágio 2, porém em maior intensidade (Figuras 3-5). Há uma maior presença dos microdepósitos em todo estroma e o endotélio também foi mais afetado que no estágio 2. Neste estágio, notou-se afilamento e tortuosidade ainda maior dos nervos corneanos. Em um paciente, no estágio 3 da ceratopatia, foram observadas coalescências maiores no epitélio basal, correspondentes aos achados biomicroscópicos (Figura 6).

A contagem endotelial média foi de 2.524 ± 150,3 células/mm2.
DISCUSSÃO
Os depósitos corneanos por amiodarona e seu metabólito ativo, desetilamiodarona, resultam da secreção destes pela glândula lacrimal(8), a qual depende de uma concentração no soro que deve ser alcançada para uma excreção significante pela glândula lacrimal(10). Esta patogênese foi confirmada quando foi observado que pacientes que tinham excessiva produção lacrimal ou usava colírios lubrificantes, diluindo e retirando os depósitos da superfície corneana, desenvolviam baixos graus de microdepósitos, comparado com a dosagem que tomavam da droga. Esta condição é fortemente relacionada à dose diária e duração do tratamento(5,9). Clinicamente, os microdepósitos corneanos são confinados ao epitélio(21), sem nenhum achado anormal observado abaixo da membrana basal. Um estudo com microscopia eletrônica descreveu a presença de corpos membranosos lamelares intracitoplasmáticos "lysosome-like" no epitélio, estroma e endotélio(12).
Empregando a microscopia confocal in vivo, este estudo mostrou que os microdepósitos epiteliais corneanos, que representam inclusões intracitoplasmáticas da amiodarona, semelhantes ao observado à microscopia eletrônica, constituem o achado mais comum da ceratopatia por amiodarona, estando presentes em todos os olhos avaliados. A morfologia do epitélio superficial não se mostrou afetada, como confirmado pela ausência de sinais clínicos correspondentes neste e em outro estudo publicado(22). Porém, observou-se que algumas células do epitélio superficial apresentam áreas de maior refletividade no núcleo e na membrana celular (Figura 2). O achado mais comum foi a presença de microdepósitos na camada epitelial basal em todos os olhos estudados, semelhantes aos encontrados em outro estudo(22) e à microscopia eletrônica(12). Ao examinar todas as camadas corneanas, verificou-se que os microdepósitos intracelulares não estão confinados ao epitélio, aparecendo em todas as camadas corneanas, quanto maior for a ceratopatia induzida. Em outro estudo com MC(22), foi observado em pacientes com ceratopatia induzida avançada (estágios 2 e 3) microdepósitos e redução significativa da densidade de ceratócitos no estroma anterior, em relação a um grupo controle. Estes depósitos no estroma anterior também foram observados no presente estudo. As alterações observadas nos nervos e endotélio corneanos nos casos avançados são semelhantes a outros estudos(12,22). Entretanto não foi estudada a possível diminuição da sensibilidade corneana nestes pacientes.
CONCLUSÃO
Observamos os achados da microscopia confocal in vivo nos microdepósitos corneanos da ceratopatia induzida por amiodarona. A observação das estruturas corneanas pela MC nesta ceratopatia induzida mostrou que o epitélio basal é o mais acometido em qualquer estágio da ceratopatia. Nos pacientes do estágio 1 à biomicroscopia, os microdepósitos estão restritos ao epitélio superficial e basal, e nos pacientes do estágio 2 e 3, os microdepósitos afetam todas camadas corneanas. Quanto maior e mais avançada a ceratopatia induzida, maior o acometimento das camadas corneanas mais profundas. À medida que a ceratopatia avança, os nervos corneanos ficam mais afilados e tortuosos.
REFERÊNCIAS
1. Burns KE, Piliotis E, Garcia BM, Ferguson KA. Amiodarone pulmonary, neuromuscular and ophthalmological toxicity. Can Respir J. 2000;7(2):193-7.
2. Mantyjarvi M, Tuppurainen K, Ikaheimo K. Ocular side effects of amiodarone. Surv Ophthalmol. 1998;42(4):360-6.
3. Francois J. [Cornea verticillata]. Bull Soc Belge Ophtalmol. 1968;150:656-70. French.
4. Davitt SP, Mannis MJ. Delayed development of amiodarone keratopathy in a corneal graft. Cornea. 1997;16(6):695-7.
5. Nielsen CE, Andreasen F, Bjerregaard P. Amiodarone induced cornea verticillata. Acta Ophthalmol (Copenh). 1983;61(3):474-80.
6. Dolan BJ, Flach AJ, Peterson JS. Amiodarone keratopathy and lens opacities. J Am Optom Assoc. 1985;56(6):468-70.
7. Ingram DV, Jaggarao NSV, Chamberlain DA. Ocular changes resulting from therapy with amiodarone. Br J Ophthalmol. 1982;66(10):676-9.
8. Pollak PT. Clinical organ toxicity of antiarrhythmic compounds: ocular and pulmonary manifestations. Am J Cardiol. 1999;84(9A):37R-45R.
9. Kaplan LJ, Cappaert WE. Amiodarone keratopathy. Correlation to dosage and duration. Arch Ophthalmol. 1982;100(4):601-2.
10. Orlando RG, Dangel ME, Schaal SF. Clinical experience and grading of amiodarone keratopathy. Ophthalmology. 1984;91(10):1184-7.
11. Rivera RP, Younge BR, Dyer JA. Atypical amiodarone-induced keratopathy in a patient wearing soft contact lenses. CLAO J. 1989;15(3):219-21.
12. Ghosh M, McCulloch C. Amiodarone-induced ultrastructural changes in human eyes. Can J Ophthalmol. 1984;19(4):178-86.
13. Cavanagh HD, Petroll WM, Alizadeh H, HE Y-G, McCulley JP, Jester JV. Clinical and diagnostic use of in vivo confocal microscopy in patients with corneal diseases. Ophthalmology. 1993;100(10):1444-54.
14. Petroll WM, Jester JV, Cavanagh HD. In vivo confocal imaging: general principles and applications. Scanning. 1994;16(3):131-49.
15. Wiegand W, Thaer AA, Kroll P, Geyer OC, Garcia AJ. Optical sectioning of the cornea with a new confocal in vivo slit-scanning videomicroscope. Ophthalmology. 1995;102(4):568-75.
16. Mustonen RK, McDonald MB, Srivannaboon S, Tan AL, Doubrava MW, Kim CK. Normal human corneal cell populations evaluated by in vivo scanning slit confocal microscopy. Cornea. 1998;17(5):485-92.
17. Victor G, Nosé W. Microscopia confocal in vivo em ceratoconone: relato de caso. Rev Bras Oftalmol. 2001;60(12):853-8.
18. Victor G, Alberti GN, Nosé W. Microscopia confocal in vivo na epitelização da interface após LASIK. Rev Bras Oftalmol. 2002;61(4):284-9.
19. Victor G, Alves MR, Nose W. Avaliação in vivo da histologia corneana após ceratotomia radial com a microscopia confocal. Rev Bras Oftalmol. 2003;62 (9):641-51.
20. Victor G, Campos PJG, Alves MR, Nosé W. Microscopia confocal in vivo na cistinose. Arq Bras Oftalmol. 2004;67(3):553-7.
21. D'Amico DJ, Kenyon KR, Ruskin JN. Amiodarone keratopathy. Drug-induced lipid storage disease. Arch Ophthalmol. 1981;99(2):257-61.
22. Ciancaglini M, Carpineto P, Zuppardi E, Nubile M, Doronzo E, Mastropasqua L. In vivo confocal microscopy of patients with amiodarone-induced keratopathy. Cornea. 2001;20(4):368-73.
Endereço para correspondência:
Gustavo Victor
Av. República do Líbano, 1034
São Paulo (SP) CEP 04502-001
E-mail: [email protected]
Recebido para publicação em 16.04.2006
Última versão recebida em 27.06.2006
Aprovação em 07.07.2006
Trabalho realizado no Eye Clinic Day Hospital - São Paulo (SP) - Brasil.