

Laura Almeida Hercules1; Magda Massae Hata Viveiros2; Silvana Artioli Schellini3; João Candeias4; Carlos Roberto Padovani5
DOI: 10.1590/S0004-27492006000600010
RESUMO
OBJETIVO: Avaliar o comportamento dos fibroblastos da cápsula de Tenon de pterígios e normais em cultura, quando expostos a ciclosporina 0,05%. MÉTODOS: Estudo prospectivo, controlado, do qual participaram 20 portadores de pterígio primário. Foram colhidas amostras da cápsula de Tenon normal e proveniente do pterígio, ambas do mesmo indivíduo, colocadas para crescimento em cultura e expostas a ciclosporina 0,05%. As avaliações foram feitas aos 3, 6, 12 e 17 dias após a exposição. RESULTADOS: Das amostras colhidas, 7 foram utilizadas para exposição a ciclosporina - 6 provenientes de pterígios e 1 da Tenon normal. Houve redução significativa na proliferação celular das culturas de fibroblastos expostos a ciclosporina (p<0,05). CONCLUSÃO: A ciclosporina 0,05% é capaz de inibir a proliferação de fibroblastos provenientes da cápsula de Tenon de pterígio e também da Tenon normal. Novos estudos devem ser providenciados para definir o papel da ciclosporina no tratamento do pterígio.
Descritores: Pterígio; Ciclosporinas; Imunossupressores; Técnicas de cultura de células; Fibroblastos
ABSTRACT
PURPOSE: To evaluate normal Tenon capsule fibroblasts and from pterygia in culture when exposed to cyclosporin 0.05%. METHODS: A prospective, randomized study was done, involving 20 patients with primary pterygium. Samples of normal and pterygium Tenon's capsule from the same individual were collected, cultured and exposed to cyclosporin 0.05%. RESULTS: Only 7 samples could be exposed to cyclosporin - 6 from pterygial Tenon's capsule and 1 from normal Tenon's capsule. There was a significant reduction of cellular proliferation in the cyclosporin exposed cultures (p<0.05). CONCLUSION: Cyclosporin 0.05% is effective to inhibit the proliferation of pterygia and normal Tenon's capsule fibroblasts. Further studies should be performed to define the role of cyclosporin in pterygium treatment.
Keywords: Pterygium; Cyclosporins, Immunosuppressive agents; Cell culture techniques; Fibroblasts
INTRODUÇÃO
O pterígio ainda tem etiopatogênese incerta, provavelmente multifatorial e seu desenvolvimento relaciona-se com exposição dos pacientes a fatores ambientais, como vento, poeira, radiação ultra-violeta, que alterariam as células germinativas limbares, apesar de não ser conhecida em outros animais e não ter sido possível reproduzir a lesão em modelos experimentais(1-2).
O desconhecimento de todas as variáveis envolvidas na gênese do pterígio impede que uma das vertentes do tratamento, a redução ou ausência do contato com os fatores desencadeantes, seja proposta. Além disso, após a remoção cirúrgica e uso de medicamentos adjuvantes, como os pacientes continuam expostos a inúmeros fatores que podem estar envolvidos na gênese do pterígio, muitos deles ainda desconhecidos, há impossibilidade de avaliação direta da possibilidade de cura frente a determinado procedimento. Por este motivo, estudos in vitro, envolvendo culturas celulares, podem controlar melhor as variáveis que determinam seu desenvolvimento e recidiva, excluindo a influência dos múltiplos fatores externos.
Pesquisando apoptose e a expressão de genes a ela relacionados (p53, bcl-2 e bax), em conjuntiva normal e em pterígios, foi observado que a interrupção no curso normal do processo de apoptose, pode estar envolvida no desenvolvimento do pterígio(3).
A apoptose é ativada pela ciclosporina A, que pode ter sua atividade mediada e potencializada pela ativação do supressor de tumor p53(4).
Estudo pregresso, demonstrou que a ciclosporina, quando utilizada por via sistêmica, foi capaz de inibir seletivamente os neovasos da córnea de camundongos, induzidos pelo fator de crescimento vascular endotelial (VEGF)(5).
O mecanismo imunológico está envolvido na patogênese do pterígio, havendo hipersensibilidade dos tipos 1 e 3, com aumento da concentração tecidual de imunoglobulinas IgE, IgG, IgA e C3 em portadores de pterígio(6-7).
Aliado à hipótese da inflamação crônica ser o fator que gera o crescimento da conjuntiva sobre a córnea, outra condição que também se supõe estar associada com inflamação mediada por linfócitos T é a síndrome do olho seco(8).
A ciclosporina A 0,05% tópica, assim como mesma droga a 2%, são utilizadas para tratamento do olho seco e da ceratoconjuntivite vernal por via tópica(9-11). Culturas de fibroblastos oriundos de indivíduos normais e pacientes com ceratoconjuntivite vernal e penfigóide foram expostas a diferentes concentrações de ciclosporina, observando-se que, em doses maiores que 10 µg/ml, houve significativa redução da proliferação e migração celular, com indução de apoptose de maneira dose-dependente, o que comprovou que a exposição a ciclosporina modifica diretamente o comportamento dos fibroblastos, sendo indicado o seu uso em desordens conjuntivais hiperproliferativas(12).
O exato mecanismo de ação da ciclosporina não é totalmente conhecido. Quando administrada sistemicamente, a ciclosporina apresenta atividade imunossupressora. Em pacientes cuja produção de lágrimas é supostamente suprimida devido à inflamação ocular associada à ceratoconjuntivite seca, acredita-se que a ciclosporina emulsão apresenta atividade imuno-moduladora parcial. Em outros indivíduos, nos quais a ceratoconjuntivite seca possui outra gênese, pode levar à diminuição da apoptose de células epiteliais conjuntivais e proteção contra perda de células globosas(13).
Estudo da distribuição da ciclosporina A na córnea, após administração oral ou tópica, demonstrou que a aplicação tópica é capaz de atingir altos níveis no epitélio corneal, maiores que aqueles alcançados pela administração via oral(14).
O objetivo deste trabalho foi estudar o comportamento dos fibroblastos da cápsula de Tenon normal e de pterígios primários em cultura, quando expostos a ciclosporina 0,05%.
MÉTODOS
Trata-se de estudo prospectivo e controlado, desenvolvido na Faculdade de Medicina de Botucatu - UNESP, São Paulo, no ano de 2005, com a aprovação da Comissão de Ética em Pesquisa em Seres Humanos, desta mesma Instituição (CEP 408/2002).
1. Pacientes estudados
Participaram do presente estudo 20 portadores de pterígio, todos localizados no setor nasal.
Todos os indivíduos foram operados por dois dos autores, tendo sido removidos o pterígio e fragmentos da cápsula de Tenon da região do pterígio e da cápsula de Tenon sadia, localizada no fórnice temporal inferior, do mesmo olho acometido. O primeiro espécime a ser removido foi o tecido são.
Imediatamente após a remoção, os fragmentos de cápsula de Tenon foram acondicionados em tubos Ependorff estéreis e hermeticamente fechados, sendo estocados à temperatura de 5ºC.
2. Grupos experimentais
Grupo Pterígio: fizeram parte da amostra de pterígios, lesões de tamanhos variados, todas primárias.
Grupo Tenon normal: obtida do mesmo indivíduo portador de pterígio. Por causa disso, adotou-se, como critério de exclusão, os portadores de pterígio temporal e nasal, no mesmo olho.
Todas as culturas foram acompanhadas e examinadas quanto à proliferação de fibroblastos e, após cultivo, subcultivos e exposição, foram avaliadas em quatro momentos experimentais: 3, 6, 12 e 17 dias após a semeadura, como descrito a seguir.
3. Metodologia para o processamento das amostras e cultivo celular
3.1. Cultivo celular
As cápsulas de Tenon dos pterígios e os fragmentos de cápsula de Tenon normal foram transportadas em tubos Ependorff até o laboratório de Imunologia do Departamento de Microbiologia e Imunologia do Instituto de Biociências da Universidade Estadual Paulista - UNESP, em período inferior a 3 horas após a exérese, para processamento das amostras.
Sob condições de assepsia e em câmara de fluxo laminar, as amostras foram colocadas em placas de Petri de 35 mm e lavadas para a remoção de células sanguíneas com meio DMEM/F12 (Gibco - USA, suplementado com 5 ml/l de vitaminas TC minimal Eagle 100X, 0,01 U/ml de insulina, 1,4 g/l de bicarbonato de sódio, 400.000 U/ml de penicilina, 40 mg/ml de Gentamicina, 5 mg/ml de Anfotericina-B, 15 µg/l de glutationa, com pH final de 7,0) e, então, cortadas em fragmentos de aproximadamente 1 mm2 usando pinça e tesoura cirúrgicas delicadas e estéreis. Estes fragmentos foram colocados em frascos de poliestireno estéreis para cultura de células, de 25 mm2 (TPP), com 1 ml de meio DMEM/F12, suplementado com 15% de soro fetal bovino (SFB) e mantidos em estufa a 37ºC, com 5% de CO2.
A adição de meio DMEM/F12 com SFB a 15% foi feita a cada 3 dias, com acompanhamento e exames das culturas sob microscópio de inversão, para a observação da morfologia e comportamento dos fibroblastos (aderência, migração e proliferação) até que se obtivesse um número satisfatório de células em cultura, definido pela observação de células com alta atividade mitótica e não confluentes, ocupando aproximadamente 2/3 da capacidade do frasco, quando, então, prosseguiu-se com a repicagem das células.
3.2 Subcultivo celular
Para o subcultivo (ou repicagem) das células, retirou-se o meio DMEM/F12 com SFB utilizando pipeta de Pasteur e realizou-se o enxágüe cuidadoso dos frascos com solução PBS (Phosphate buffered saline). A seguir os mesmos foram incubados com uma solução de EDTA (Gibco - USA) e tripsina Versece 0,2% (Instituto Adolfo Lutz), durante 3 minutos, em estufa a 37ºC.
Com o microscópio de inversão, observou-se o desprendimento das células e, então, inativou-se a tripsina com a adição de 2 ml de meio DMEM/F12, acrescido com 20% de SFB. Esta suspensão celular foi, então, dividida em duas partes iguais, ficando uma no mesmo frasco e outra em um novo frasco estéril. Ambos foram colocados novamente em estufa até chegarem à semiconfluência, quando foram novamente subcultivadas, até se chegar ao terceiro subcultivo.
4. Método para exposição das culturas a ciclosporina
Foram selecionadas para exposição a ciclosporina 0,05% (Restasis® - Allergan Laboratórios) as amostras que alcançaram contagem suficiente para a distribuição igualitária em 16 do total de 24 poços dos Multiwells.
Foram distribuídos 5.000 fibroblastos em cada poço, sendo que o método para retirada dessas células em subcultivo foi semelhante aos subcultivos anteriores.
Através da contagem das células, distribuiu-se cada amostra em 16 quantidades iguais de fibroblastos, para que, em cada momento de contagem, fossem utilizados 4 poços dos Multiwells.
Vinte e quatro horas após a distribuição das células nos Multiwells, foi feita a exposição dos fibroblastos a 0,1 ml de ciclosporina 0,05% em 3 de cada 4 poços que continham os fibroblastos, num total de 12 compartimentos contendo ciclosporina 0,05% e 4 não expostos (utilizados como controles de não exposição à droga). Todos os 16 poços de cada amostra foram completados com 0,5 ml do meio de cultura (DMEM/F12 acrescido com 20% de SFB).
Portanto, a pesquisa em cada um dos indivíduos foi realizada em triplicata, o que torna a contagem dos fibroblastos mais confiável.
Após a exposição das células à ciclosporina, foram feitas as contagens em quatro momentos: a primeira contagem foi realizada 3 dias após a exposição; a segunda 6 dias após a exposição, a terceira 12 dias após a exposição e a quarta contagem foi realizada 17 dias após a exposição.
5. Metodologia para contagem dos fibroblastos
O método para contagem de fibroblastos foi através de hemocitômetro (câmara de Neubauer). Primeiramente as células foram expostas à tripsina, de modo a obter uma suspensão homogênea de fibroblastos, sem grumos. Com uma pipeta Pasteur de ponta fina, a suspensão foi homogeneizada, pipetando-se algumas vezes para cima e para baixo. Cinqüenta µl da suspensão foram retirados e diluídos com 50µl de azul de metileno, pois o corante marca os fibroblastos inviáveis, para que estes não fossem contados.
Uma amostra foi retirada com pipeta e aplicada nos locais indicados na câmara de Neubauer, de forma que o líquido escorresse por capilaridade entre a lâmina e a lamínula, aguardando-se alguns segundos, focalizando-se e contando-se todas as células do quadrado delimitado grande central (16 quadrados menores), com aumento de 100 vezes.
Como o número de fibroblastos em cada quadrado grande era menor de 100, foram contados 5 quadrados. A concentração foi dada por:
 x 2 = nºde friblastos/ml
x 2 = nºde friblastos/ml
6. Análise estatística
O estudo da contagem de fibroblastos nos dois grupos experimentais e nos 4 momentos de avaliação foi realizado considerando a técnica não-paramétrica da Análise de Variância dos postos para o modelo de medidas repetidas em dois grupos independentes. Todas as discussões dos resultados foram realizadas no nível de 5% de significância(15).
RESULTADOS
O subcultivo celular foi possível no material proveniente de 6 portadores de pterígio e 1 cápsula de Tenon normal.
Assim, no material proveniente de 7 pacientes foi possível obter número de fibroblastos suficiente para realizar a exposição em triplicata, controle e contagem em quatro diferentes momentos.
Em todos os quatro momentos de observação (3º, 6º, 12º e 17º dias), as amostras expostas à droga diferiram estatisticamente dos controles, tendo-se observado que não houve diferença entre as medidas no 3º e 6º dias no grupo controle e, nesses dois momentos, a quantidade de células foi menor quando comparada ao 12º dia e neste, menor que no 17º dia (Gráfico 1).
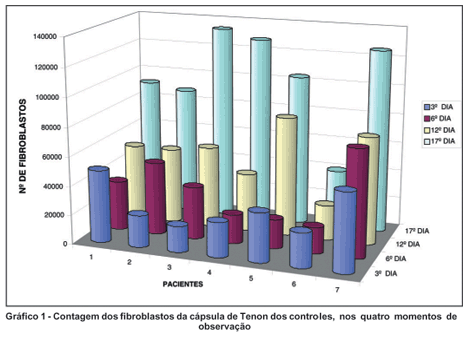
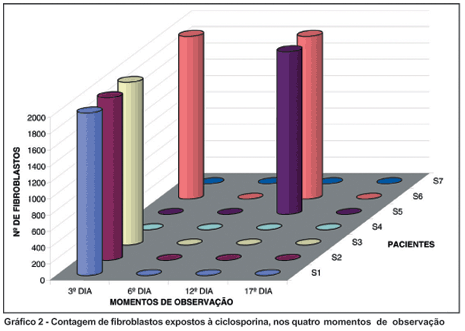
Quanto ao grupo exposto à droga, no 3º dia, o número de fibroblastos foi estatisticamente maior que nas contagens subseqüentes. Os pacientes 4 e 5 apresentavam fibroblastos viáveis no 12º dia de exposição, diferentemente dos demais, que já não tinham células contáveis no 12º dia (Gráfico 2).
DISCUSSÃO
Dentre todas as amostras inicialmente incluídas neste estudo, apenas 7 foram objeto de análise em função das dificuldades de manter as células em cultivo em condições adequadas.
A inviabilidade do cultivo ocorreu devido à ausência de migração dos fibroblastos em alguns casos e à baixa taxa de proliferação destas células em outros, não permitindo que as culturas atingissem a semiconfluência para serem subcultivadas até a terceira passagem, já que são as células de terceira passagem que devem ser utilizadas para a exposição às drogas em experimentos que envolvem cultivo celular.
O crescimento de células em cultivo é dificultoso, havendo necessidade de se controlar o ambiente, fornecer nutrientes e antibióticos(16). Portanto, há necessidade de se coletar um número representativo de amostras para que se consiga obter quantidade expressiva de subcultivos, além de cuidados com a coleta do material, uma vez que pode haver contaminação com células epiteliais com os fibroblastos da cápsula de Tenon, havendo necessidade de se utilizar materiais cirúrgicos e de acondicionamento diferentes para manipulação de cada amostra, para evitar problemas que impeçam a realização do experimento.
Além das dificuldades inerentes para o cultivo e subcultivo de células em cultura, já havia sido observado que a Tenon dos pterígios é mais facilmente cultivável do que a Tenon normal(16). O mesmo foi observado no presente estudo, quando apenas 1 espécime de Tenon normal pôde ser utilizado.
A resposta dos fibroblastos à exposição a ciclosporina não foi uniforme, o que pode ser constatado pela observação do gráfico 2, quando duas amostras apresentavam ainda fibroblastos viáveis 12 dias após a exposição. Esta variabilidade de resposta pode ser a explicação para o fato de alguns indivíduos apresentarem comportamento diferente frente aos procedimentos empregados no tratamento.
Nas condições do estudo, a ciclosporina foi efetiva em evitar a proliferação dos fibroblastos da cápsula de Tenon de pterígios. Até que ponto este resultado pode ser extrapolado para a condição clínica, é um ponto ainda discutível, embora já existam pelo menos dois relatos de emprego clínico da ciclosporina a 1% ou a 0,05% para prevenção de recidiva do pterígio(17-18).
Outro tipo de utilização possível poderia ser na profilaxia do crescimento da lesão, possibilitando que o paciente não chegasse à indicação cirúrgica, mas este comentário é ainda especulativo.
Os resultados do presente estudo permitiram conhecer o papel da ciclosporina na proliferação de fibroblastos conjuntivais normais e de pterígios in vitro, mostrando que a droga é efetiva em reduzir esta proliferação. Desta forma, ensaios clínicos devem ser feitos a fim de determinar o papel da ciclosporina como droga coadjuvante para o tratamento do pterígio.
CONCLUSÃO
A ciclosporina 0,05% reduziu significativamente a proliferação dos fibroblastos provenientes da cápsula de Tenon de pterígios e normal. Novos estudos devem ser incentivados com o objetivo de estabelecer o real papel da ciclosporina tópica no tratamento do pterígio.
REFERÊNCIAS
1. Duke-Elder WS. Textbook of ophthalmology. St Louis: Mosby. 1954. v.7. p.570-86.
2. Kwok LS, Coroneo MT. A model for pterygium formation. Cornea. 1994; 13(3):219-24.
3. Tan DT, Tang WY, Liu YP, Goh HS, Smith DR. Apoptosis and apoptosis related gene expression in normal conjunctiva and pterygium. Br J Ophthalmol. 2000;84(2):212-6.
4. Pyrzynska B, Serrano M, Martinez-A C, Kaminska B. Tumor suppressor p53 mediates apoptotic cell death triggered by cyclosporin A. J Biol Chem. 2002; 277(16):14102-8.
5. Hernandez GL, Volpert OV, Iniguez MA, Lourenzo E, Martinez-Martinez S, Grau R, et al. Selective inhibition of vascular endothelial growth factor - mediated angiogenesis by cyclosporin A: roles of the nuclear factor of activated T cells and cyclooxygenase 2. J Exp Med. 2001;193(5):607-20.
6. Liu L, Yang D. Immunological studies on the pathogenesis of pterygium. Chin Med Sci J. 1993;8(2):84-8.
7. Pinkerton OD, Hokama Y, Shigemura LA. Immunologic basis for the pathogenesis of pterygium. Am J Ophthalmol. 1984;98(2):225-8.
8. Kunert KS, Tisdale AS, Stern ME, Smith JA, Gipson IK. Analysis of topical cyclosporine treatment of patients with dry eye syndrome: effect on conjunctival lymphocytes. Arch Ophthalmol. 2000;118(11):1489-96.
9. Perry HD, Donnenfeld ED. Topical 0.05% cyclosporin in the treatment of dry eye. Expert Opin Pharmacother. 2004;5(10):2099-107.
10. Pucci N, Novembre E, Cianferoni A, Lombardi E, Bernardini R, Caputo R, et al. Efficacy and safety of cyclosporine eyedrops in vernal keratoconjunctivitis. Ann Allergy Asthma Immunol. 2002;89(3):298-303.
11. Bhargava A, Jackson WB, El-Defrawy SR. Ocular allergic disease. Drugs Today (Barc). 1998;34(11):957-71.
12. Leonardi A, DeFranchis G, Fregona IA, Violato D, Plebani M, Secchi AG. Effects of cyclosporin A on human conjunctival fibroblasts. Arch Ophthalmol. 2001;119(10):1512-7.
13. Strong B, Farley W, Stern ME, Pflugfelder SC. Topical cyclosporine inhibits conjunctival epithelial apoptosis in experimental murine keratoconjunctivitis sicca. Cornea. 2005;24(1):80-5.
14. Theng J, Zhou L, Tan D, La KW. Distribution of cyclosporin A in the cornea after topical or oral administration. J Ocul Pharmacol Ther. 2002;18(1):83-8.
15. Norman GR, Streiner DL. Biostatistics: the bare essentials. St. Louis: Mosby. 1994. 240p.
16. Viveiros MMH, Schellini SA, Rainho C, Rogatto SR, Padovani CR. Análise do cultivo de fibroblastos da cápsula de Tenon de pterígios primários e recidivados [abstract]. Arq Bras Oftalmol. 2004;67(4 Supl):37. [Resumos dos Temas Livres do XVI Congresso Brasileiro de Prevenção da Cegueira e Reabilitação Visual].
17. Wu H, Chen G. [Cyclosporine A and thiotepa in prevention of postoperative recurrence of pterygium]. Yan Ke Xue Bao. 1999;15(2):91-2. Chinese.
18. Hasegawa DS, Hoyama E, Dalamas JC, Hasegawa N, Yagui N. Uso de ciclosporina 0,05% colírio no pós-operatório do pterígio [abstract]. In: XXX International Congress of Ophthalmology; 2006 Feb 19-24. Abstract Book. São Paulo. 2006. p.64.
Endereço para correspondência:
Silvana Artioli Schellini
DEP. OFT/ORL/CCP - Faculdade de Medicina de Botucatu - UNESP
Botucatu (SP) CEP 18618-970
E-mail: [email protected]
Recebido para publicação em 22.09.2005
Última versão revisada recebida em 11.03.2006
Aprovação em 26.03.2006
Este estudo recebeu financiamento da FAPESP para sua execução.
Nota Editorial: Depois de concluída a análise do artigo sob sigilo editorial e com a anuência do Dr. Sérgio Felberg sobre a divulgação de seu nome como revisor, agradecemos sua participação neste processo.