

Marcos Pereira de Ávila1; André Moraes Freitas3; David Leonardo Cruvinel Isaac2; André Luis de Moura Bastos3; Rafael Valadares Pena3
DOI: 10.1590/S0004-27492006000200022
RESUMO
O interferon é uma citocina imunomoduladora utilizada no tratamento de diversas doenças, incluindo infecções crônicas pelo vírus da hepatite C. O interferon peguilado é uma nova forma de interferon, desenvolvida para aumentar o tempo de meia-vida da droga. Uma série de efeitos adversos têm sido associados ao uso do interferon, dentre eles a toxicidade ocular com desenvolvimento de retinopatia. As lesões oculares típicas incluem exsudatos algodonosos e hemorragias retinianas no pólo posterior, particularmente em torno do disco óptico. Descrevemos o caso de paciente tratado com associação de interferon peguilado e ribavirina com diminuição da acuidade visual e quadro oftalmológico compatível com retinopatia associada ao interferon. Quatro semanas após a suspensão do interferon, houve melhora da acuidade visual e diminuição importante das alterações retinianas.
Descritores: Hepatite C; Interferon alfa-2a; Ribavirina; Quimioterapia combinada; Retina; Retinite pigmentosa; Acuidade visual; Relatos de casos
ABSTRACT
Interferon is an immunomodulating cytokine used to treat patients with different diseases, such as hepatitis C chronic infection. Pegylated interferon is a new type of interferon, developed to increase the half-life of the drug. Many side effects have been related to its use, including ocular toxicity and retinopathy. The most reported ocular findings are cotton-wool spots and hemorrhages located at the posterior pole and surrounding optic nerve head. We describe one case of pegylated interferon-associated retinopathy with visual loss. The patient had visual acuity improvement four weeks after discontinuation of the medication and the ocular findings became much more subtle.
Keywords: Hepatitis C; Interferon alfa-2a; Ribavirin; Drug therapy; combination; Retina; Retinitis pigmentosa; Visual acuity; Case reports
INTRODUÇÃO
O interferon é uma citocina imunomoduladora, produzida naturalmente por linfócitos em resposta às infecções virais(1). Possui atividade antiviral direta em culturas celulares, propriedades antiangiogênicas e antiproliferativas. Sintetizado, é utilizado, em seus subtipos, no tratamento de diversas doenças incluindo o sarcoma de Kaposi, hemangiomas da infância, melanomas cutâneos, carcinoma renal metastático e infecções crônicas causadas pelo vírus da hepatite C (VHC)(2-10).
A infecção causada pelo vírus da hepatite C é responsável, nos Estados Unidos, por aproximadamente 10.000 óbitos a cada ano, sendo ainda a principal causa de transplantes de fígado naquele país(11). No Brasil, estima-se que de 3,9 a 7,6 milhões de pessoas estejam infectadas pelo VHC (2,5 a 4,9% da população)(12).
O uso de interferon constitui, atualmente, a única modalidade terapêutica aprovada pelo FDA americano (Food and Drug Administration) para o tratamento da hepatite C, seja através da sua utilização sob a forma de monoterapia (interferon alfa ou interferon peguilado) ou associada a drogas como a ribavirina. A partir do fim dos anos 90 intensificou-se, no Brasil, a associação entre o interferon e a ribavirina no tratamento da infecção crônica pelo VHC, inclusive com distribuição gratuita da medicação em determinadas regiões do país(13).
Diversos estudos demonstraram efeitos colaterais associados ao uso de interferon, dentre eles alterações oculares, sobretudo retinianas(14-19). São relatos de retinopatia associada ao uso de interferon alfa e ribavirina, enquanto poucos estudos evidenciaram alterações retinianas relacionadas ao uso de interferon peguilado.
Descreve-se o caso de um paciente tratado com associação interferon peguilado e ribavirina com quadro oftalmológico compatível com o de retinopatia associada ao interferon.
RELATO DE CASO
Paciente de 55 anos, sexo masculino, branco, procurou espontaneamente o serviço de oftalmologia com queixa de piora da acuidade visual no olho direito há aproximadamente 2 semanas. Portador de hepatite C e submetido a transplante hepático há 26 meses, é usuário de interferon peguilado, ribavirina e ciclosporina desde então e nega hipertensão arterial (pressão arterial normal, aferida após consulta oftalmológica), diabetes mellitus ou qualquer outra doença sistêmica.
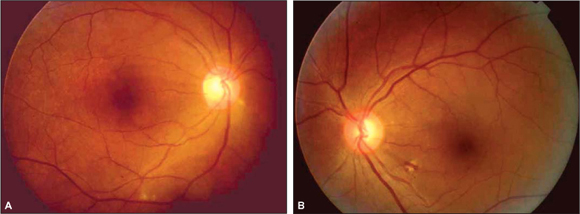
Ao exame oftalmológico observou-se acuidade visual corrigida de 20/200 no olho direito e de 20/20 no olho esquerdo. À oftalmoscopia indireta evidenciou-se no olho direito: retina colada, hiperemia do disco óptico com múltiplos exsudatos algodonosos circunjacentes, discreta tortuosidade e dilatação venosa, esparsas hemorragias retinianas e exsudatos algodonosos no pólo posterior e média periferia (Figura 1). O olho esquerdo apresentava alguns exsudatos algodonosos, porém sem outras alterações. À tonometria, medida com tonômetro de Goldman, registraram-se valores de 12 mmHg em ambos os olhos. A biomicroscopia e a motilidade ocular se mostraram normais em ambos os olhos.
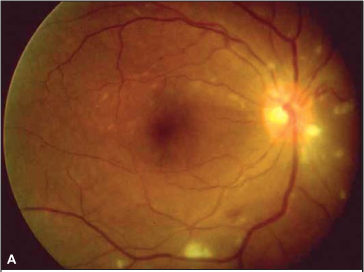
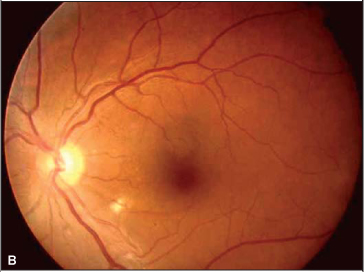
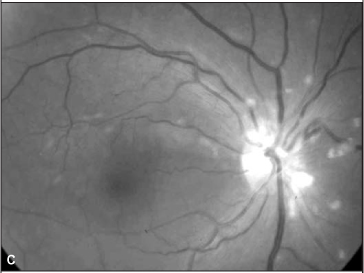
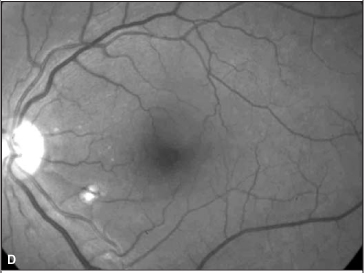
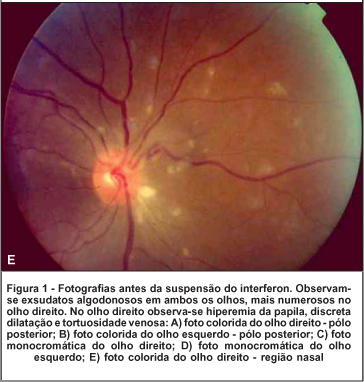
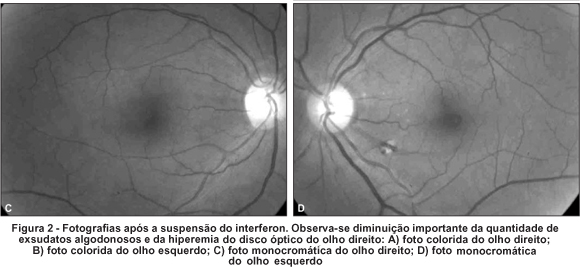
Foi suspenso o uso de interferon e o exame oftalmológico, após 4 semanas, revelou melhora na acuidade visual corrigida (olho direito = 20/50 e olho esquerdo = 20/20). A oftalmoscopia indireta e a biomicroscopia de fundus ocular revelaram diminuição importante da quantidade de exsudatos algodonosos, das hemorragias retinianas e da hiperemia de nervo óptico (Figura 2). O paciente relatou melhora acentuada da acuidade visual.
DISCUSSÃO
Uma série de efeitos adversos têm sido associados ao uso do interferon. Há a descrição de reações tóxicas, incluindo efeitos colaterais agudos (febre, calafrios, mialgia, artralgia e cefaléia) e efeitos crônicos, onde prevalece a fadiga. Também foram relatados toxicidade ao sistema nervoso central, sistema hematopoiético, gastrointestinal, renal, cutâneo, musculoesquelético, cardiovascular e endócrino, sem se mencionar toxicidade ocular(2).
Em 1990, alguns autores relataram, pela primeira vez, o achado de hemorragias retinianas e exsudatos algodonosos retinianos após a administração endovenosa de interferon(16). Desde 1992, a terapia da hepatite viral com interferon tem sido usada em vários hospitais do Japão, onde há alta prevalência de hepatite C. A partir de 1993, vários casos de toxicidade ocular foram relatados, sendo a maior parte deles proveniente da literatura japonesa(20).
As lesões oculares típicas incluem exsudatos algodonosos e hemorragias retinianas no pólo posterior, particularmente em torno do disco óptico, que podem ou não ser bilaterais. A angiografia revela bloqueio da fluorescência de fundo causada pelas hemorragias retinianas e pelas áreas de não perfusão dos exsudatos algodonosos(17-18).
A retinopatia surge aproximadamente duas semanas após o início da terapia, podendo desaparecer espontaneamente durante o tratamento ou rapidamente após a interrupção do mesmo(17). Apesar da retinopatia, as queixas subjetivas dos pacientes acometidos têm sido incomuns e a acuidade visual nem sempre é afetada(18).
Não existe estudo relatando a incidência exata da retinopatia, variando de 18% (19) a 86% (21), aparentemente dependendo da dose utilizada. A incidência é maior em pacientes com diabetes mellitus. Não há evidências de diferença na incidência de retinopatia entre pacientes em uso de interferon alfa e interferon beta(21).
Alguns autores relataram pacientes com provável retinopatia pelo vírus da hepatite C(22). Hemorragias retinianas e exsudatos algodonosos foram observados em pacientes com hepatite C crônica sem uso de interferon. Nenhum outro autor relatou retinopatia associada ao vírus da hepatite C, incluindo três estudos prospectivos envolvendo 156 pacientes com hepatite C crônica antes do início do tratamento com interferon. Tais achados talvez sejam explicados pela variabilidade genética do vírus da hepatite C(22). Outros estudos demonstraram a associação entre o vírus da hepatite C e trombose, sugerindo que o vírus possa ter um efeito na ativação do sistema de coagulação(23).
É possível que a patogênese da retinopatia associada ao uso de interferon e ao vírus da hepatite C estejam relacionadas, sendo provável que uma doença vascular retiniana pré-existente, como diabete ou retinopatia associada ao vírus da hepatite C, predisponham o desenvolvimento de retinopatia associada ao uso de interferon. O depósito de imunocomplexos, disfunção imune e aumento da adesividade de leucócitos ativados na parede vascular têm sido sugeridos na patogênese(20,24).
Uma nova forma de interferon foi desenvolvida, chamada interferon peguilado ou peginterferon. A peguilação é uma técnica desenvolvida pela indústria de cosméticos e também utilizada na produção de alimentos, que consiste em unir uma molécula de polietilenoglicol à molécula de interferon. Tornando-se maior, o interferon é mais dificilmente metabolizado, o que permite que suas dosagens sangüíneas permaneçam elevadas por um maior tempo. A atividade biológica do interferon permanece qualitativamente inalterada e a sua administração, ao invés de três vezes por semana, passa a ser semanal(25-26). Um ensaio clínico randomizado aberto de fase 3 que compara o uso de interferon convencional mais ribavirina versus interferon peguilado mais ribavirina(27) mostrou um pequeno benefício da combinação utilizando interferon peguilado e ribavirina sobre a combinação interferon convencional e ribavirina(27-28).
No caso aqui relatado, descreve-se a retinopatia por interferon peguilado, que difere da grande maioria dos casos relatados de retinopatia associada ao uso de interferon alfa ou beta convencionais. Chama também a atenção, neste caso, a manifestação ocular tardia, pois o paciente vinha fazendo uso da medicação há aproximadamente dois anos antes de desenvolver sintomas. A baixa da acuidade visual do olho direito ocorreu, provavelmente, por má perfusão capilar retiniana na região macular, evidenciada por alguns exsudatos algodonosos no pólo posterior, e também pelo acometimento do nervo óptico: a retinografia colorida revela hiperemia de disco óptico e borramento do seu bordo superior. Há pubicações que relatam acometimento do nervo óptico associado ao quadro de retinopatia(10). Tanto as alterações de pólo posterior quanto do nervo óptico não são evidenciadas nas retinografias tomadas após a suspensão da medicação.
Trabalhos publicados questionam a necessidade de exame oftalmológico de rotina em pacientes assintomáticos em tratamento com interferon(29). Por outro lado, existem estudos relatando perda visual grave em alguns pacientes em tratamento com interferon(30), sugerindo acompanhamento até que o quadro oftalmológico seja resolvido, pois a retinopatia é um efeito adverso potencialmente grave(31).
Torna-se necessária a descrição de maior número de casos com observações anatômicas adequadas, na tentativa de correlacionar a manifestação de longo prazo desta medicação em contraposição com a manifestação aguda observada em pacientes em uso de interferon convencional.
REFERÊNCIAS
1. Isaacs A, Lindenmann J. Virus interference. I The interferon. Proc R Soc Lond B Biol Sci. 1957;147(927):258-67.
2. Quesada JR, Rios A, Swanson D, Trown P, Gutterman JU. Antitumor activity of recombinant-derived interferon alpha in metastatic renal cell carcinoma. J Clin Oncol. 1985;3(11):1522-8.
3. Krown SE, Real FX, Krim M, et al. Recombinant leukocyte A interferon in Kaposi's sarcoma. Ann NY Acad Sci. 1984;437:431-8.
4. White CW, Sondheimer HM, Crouch EC, Wilson H, Fan LL. Treatment of pulmonary hemangiomatosis with recombinant interferon alfa-2a. N Engl J Med. 1989;320(18):1197-200.
5. Miller JW, Stinson WG, Folkman J. Regression of experimental iris neovascularization with systemic alpha-interferon. Ophthalmology. 1993;100(1):9-14.
6. Fung WE. Interferon alpha 2a for treatment of age-related macular degeneration. Am J Ophthalmol. 1991;112(3):349-50.
7. Poliner LS, Tornambe PE, Michelson PE, Heitzmann JG. Interferon alpha-2a for subfoveal neovascularization in age-related macular degeneration. Ophthalmology. 1993;100(9):1417-24. Comment in: Ophthalmology. 1994;101(4):624-5.
8. Sundmacher R, Cantell K, Skoda R, Hallermann C, Neumann-Haefekin D. Human leukocyte and fibroblast interferon in a combination therapy of dendritic keratitis. Albrecht Von Graefes Arch Klin Exp Ophthalmol. 1978;208(4):229-33.
9. Gillies M, Francis I, McCluskey P, Wakefield D. Local interferon alfa-2b for ocular cicatricial pemphigoid. Br J Ophthalmol. 1996;80(10):927.
10. Schulman JA, Liang C, Kooragayala LM, King J. Posterior segment complications in patients with hepatitis C treated with interferon and ribavirin. Ophthalmology. 2003;110(2):437-42.
11. Cheney CP, Chopra S, Graham C. Hepatitis C. Infect Dis Clin North Am. 2000;14(3):633-67.
12. Hepatitis C - global prevalence (update). Wkly Epidemiol Rec. 2000;75(3):18-9.
13. Alves AV, Azevedo APC, Perin C, Ramos GZ, Brandão ABM, Mattos AA, et al. Tratamento de pacientes com hepatite crônica pelo vírus C com interferon-alfa e ribavirina: a experiência da Secretaria de Saúde do Rio Grande do Sul. Arq Gastroenterol. 2003;40(4):227-32.
14. Tu KL, Bowyer J, Schofield K, Harding S. Severe interferon associated retinopathy. Br.J.Ophthalmol. 2003;87(2):247-8.
15. Quesada JR, Talpaz M, Rios A, Kurzrock R, Gutterman JU. Clinical toxicity of interferons in cancer patients: a review. J Clin Oncol. 1986;4(2):234-43.
16. Ikebe T, Nakatsuka K, Goto M, Sakai Y, Kageyama S. A case of retinopathy induced by intravenous administration of interferon. Folia Ophthalmol Jpn. 1990;41:2291-6.
17. Tokai R, Ikeda T, Miyaura T, Sato K. Interferon-associated retinopathy and cystoid macular edema. Arch Ophthalmol. 2001;119(7):1077-9.
18. Hayasaka S, Fujii M, Yamamoto Y, Noda S, Kurome H, Sasaki M. Retinopathy and subconjunctival haemorrhage in patients with chronic viral hepatitis receiving interferon alfa. Br J Ophthalmol. 1995;79(2):150-2.
19. Takikawa H, Kawakubo H, Yuzawa M. Interferon associated retinopathy induced by interferon. Ganka. 1994;36:189-93.
20. Hayasaka S, Nagaki Y, Matsumoto M, Sato S. Interferon-associated retinopathy. Br J Ophthalmol. 1998;82(3):323-5.
21. Soushi S, Kobayashi F, Obazawa H, Kigasawa K, Shiraishi K, Itakura M, et al. [Evaluation of risk factors of interferon-associated retinopathy in patients with type C chronic active hepatitis]. Nippon Ganka Gakkai Zasshi. 1996;100(1):69-76. Japanese.
22. Abe T, Sakuragi S, Kuramitsu T. Retinopathy associated with hepatitis C virus. Jpn J Clin Ophthalmol (Rinsho Ganka). 1993;47:297-300.
23. Violi F, Ferro D, Basili S, Artini M, Valesini G, Levrero M, et al. Increased rate of thrombin generation in hepatitis C virus cirrhotic patients. Relationship to venous thrombosis. J Invest Med. 1995;43(6):550-4.
24. Sugasawa K, Hagiwara M, Okami T. Causative factors of interferon retinopathy. Jpn J Clin Ophthalmol (Rinsho Ganka). 1996;50:385-9.
25. Reddy KR. Development and pharmacokinetics and pharmacodynamics of pegylated interferon alfa-2a (40 kD). Semin Liver Dis. 2004;24 Suppl 2:33-8.
26. Zeuzem S, Welsch C, Herrmann E. Pharmacokinetics of peginterferons. Semin Liver Dis. 2003;23 Suppl 1:23-8.
27. Manns MP, McHutchison JG, Gordon SC, Rustgi VK, Shiffman M, Reindollar R, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic treatment of chronic hepatitis C: a randomized trial. Lancet. 2001;358(9285):958-65. Comment in: J Hepatol. 2003;39(1):136-8.
28. Fried MW, Shiffman ML, Reddy KR, Smith C, Marinos G, Goncales FL Jr, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med. 2002; 347(13):975-82. Comment in: J Hepatol. 2003; 39(1):136-8; N Engl J Med. 2003;348(3):259-60; author reply 259-60.
29. Cuthbertson FM, Davies M, McKibbin M. Is screening for interferon retinopathy in hepatitis C justified? Br J Ophthalmol. 2004;88(12):1518-20.
30. Hejny C, Sternberg P, Lawson DH, Greiner K, Aaberg TM Jr. Retinopathy associated with high-dose interferon alfa-2b therapy. Am J Ophthalmol. 2001; 131(6):782-7.
31. Willson RA. Visual side effects of pegylated interferon during therapy for chronic hepatitis C infection. J Clin Gastroenterol. 2004;38(8):717-22.
Endereço para correspondência:
André Moraes Freitas
Rua Gonçalo de Carvalho, 255/503
Porto Alegre (RS)
CEP 90035-170
E-mail: [email protected]
Recebido para publicação em 04.04.2005
Versão revisada recebida em 02.10.2005
Aprovação em 04.11.2005
Trabalho realizado no Centro Brasileiro de Cirurgia de Olhos - CBCO, Goiânia (GO) - Brasil.