

Ayrton Roberto Branco Ramos1; Paulo Afonso Bracarense Costa2; Eglas Emanuel Rossi3; Carlos Augusto Moreira Júnior4; Lawrence Paul Chong5
DOI: 10.1590/S0004-27492002000500008
RESUMO
Objetivo: Os métodos terapêuticos para o tratamento dos melanomas de coróide incluem a observação, a radioterapia, a cirurgia e a laserterapia. Para acompanhamento do crescimento tumoral, há necessidade de documentação e medida do tamanho desses tumores. O objetivo deste estudo é apresentar um modelo matemático simples e de baixo custo, para medida de áreas desses tumores do fundo de olho. Métodos: Utilizaram-se 25 olhos de coelhos pigmentados. Fragmentos de melanomas amelanóticos de hamster foram implantados cirurgicamente no espaço supracoroideo dos olhos dos animais. Quando os tumores atingiram 3 a 4 diâmetros papilares de tamanho realizaram-se as retinografias e angiografias fluorescentes com retinógrafo sem Imaginet, com foco fixo. Por meio de cálculos matemáticos verificaram-se as áreas reais dos tumores. Resultados: Foi possível verificar as áreas reais dos tumores e na análise da comparação dos valores das médias obtidas para os tumores, verificou-se que não existiu diferença estatisticamente significativa entre eles (p= 0,717). Conclusões: Concluiu-se neste estudo, que com o uso de retinógrafo sem Imaginet, foi possível medir com acurácia e segurança, por meio de cálculo matemático, a área de melanomas amelanóticos de hamster implantados no espaço supracoroídeo de coelhos.
Descritores: Melanoma amelanótico; Melanoma amelanótico; Neoplasias da coróide; Terapia por laser de baixa intensidade; Modelos matemáticos; Animal; Coelhos
ABSTRACT
Purpose: Methods of management for choroidal melanomas include basically observation, radiotherapy, surgery, and laser therapy. A reliable measure of the size of the tumor is very important to follow tumor growth. The purpose of this experimental study is to verify the reliability of a low-cost mathematical model to measure areas of tumors of the fundus. Methods: Twenty-five eyes of pigmented rabbits were used in this study. Experimental Greene hamster amelanotic choroidal melanomas were implanted into the suprachoroidal space. When the tumors reached 3 to 4 papillary diameters, we performed retinography and fluorescein angiograms with a fixed focus retinal camera without Imaginet. Through a mathematical formula we found the real values of tumor areas. Results: It was possible to verify the real value of tumor areas and it was possible to verify by a comparative analysis that there was no statistically significant difference between them (p=0.717). Conclusions: We concluded that with a non-Imaginet retinal camera and a mathematical formula, it was possible to measure accurately the real areas of the hamster amelanotic melanomas implanted into the suprachoroidal space of rabbits.
Keywords: Melanoma, amelanotic; Melanoma; amelanotic; Melanoma; amelanotic; Choroid neoplasms; Laser therapy; low-level; Mathematical models; Animal; Rabbits
Avaliação da área de melanomas amelanóticos de coróide em coelhos. Modelo matemático*
An assessment of rabbit's choroidal amelanotic melanomas area. Mathematical model
Ayrton Roberto Branco Ramos1
Paulo Afonso Bracarense Costa2
Eglas Emanuel Rossi3
Carlos Augusto Moreira Júnior4
Lawrence Paul Chong5
INTRODUÇÃO
O melanoma é uma neoplasia dos melanócitos e das células névicas que, além da pele e de outros órgãos, pode acometer também os olhos.
Os melanomas oculares, todavia, são os melanomas não cutâneos mais comuns; porém raros, se comparados aos cutâneos. Aproximadamente, 1.200 novos casos de melanomas oculares, e 32.000 casos de melanomas cutâneos são diagnosticados por ano, nos Estados Unidos da América(1). Observe-se que, em contraste com as crescentes taxas de incidência e mortalidade causadas por melanomas cutâneos, as taxas de incidência e de mortalidade cujas causas são melanomas oculares, têm-se mantido relativamente estáveis nas últimas décadas; entretanto, há aumento proporcional ao aumento populacional(2).
Entre os melanomas oculares, incluem-se os melanomas uveais, que compreendem os da íris, do corpo ciliar e da coróide, bem como os melanomas conjuntivais e os palpebrais. Os melanomas oculares mais comumente localizam-se na úvea e, freqüentemente, os melanomas uveais crescem a partir de nevos uveais pré-existentes, cujas tendências de crescimento progressivo causam alterações da visão. Em alguns pacientes portadores de melanomas uveais, podem ocorrer metástases, geralmente para o fígado e, menos freqüentemente, para os pulmões e para outros órgãos(3).
A importância do estudo sobre melanomas oculares reside no fato de esta morbidade ser potencialmente letal em seres humanos. Ambos, homens e mulheres, são afetados na mesma proporção; entretanto há incidência maior em pacientes brancos do que em pacientes negros(4). Esses melanomas oculares são, via de regra unilaterais e são diagnosticados em pacientes em cuja média de idade é de 55 anos. A sobrevida, após 15 anos, é de aproximadamente 50%(1).
Os melanomas de coróide representam 85% de todos os melanomas oculares e são muito diferentes pela variação em sua apresentação clínica(4). Localizam-se mais comumente nas regiões macular e periferia retiniana próxima e se caracterizam por serem tumores largos, pigmentados, ovalados, elevados, de coloração marrom escuro ou preto, porém alguns deles podem ser amelanóticos. O crescimento tumoral causa rupturas da membrana de Bruch, acúmulos de pigmentos de lipofuscina no epitélio pigmentado da retina, rupturas de coróide, exsudações lipoprotêicas e hemorragias vítreas; em fase tumoral mais avançada, podem ocorrer descolamento exsudativo de retina, glaucoma secundário, catarata e uveíte. Os melanomas de coróide podem ser, no entanto, assintomáticos e diagnosticados apenas por ocasião de exames de rotina. É relevante o fato de que, com a ruptura da membrana de Bruch, não há mais barreira para o respectivo crescimento do tumor, cuja aparência se assemelha à de cogumelo. Ainda, tumores grandes, elevados, com crescimento documentado fotograficamente, uma vez associados à presença de líquido sub-retiniano e a descolamento exsudativo da retina, são sugestivos de melanoma maligno. Por outro lado, nos nevos de coróide e de outros tumores coroidianos, raramente há esses sinais(5).
O diagnóstico dos melanomas de coróide é feito principalmente pela oftalmoscopia indireta, biomicroscopia retiniana com lente de contato, transiluminação, retinografia, angiografia fluoresceínica, ultra-sonografia e campimetria. Havendo suspeita de extensões tumorais extra-oculares, a tomografia computadorizada e a ressonância magnética podem ser empregadas. Exames invasivos como o teste da captação de fósforo32, o qual apresenta limitações para o efeito de diagnose de tumores pequenos, e a biópsia dirigida pela ultra-sonografia, que é tecnicamente difícil de ser realizada, podem também auxiliar o diagnóstico em casos de melanomas de coróide. É importante salientar a possibilidade de os exames diagnósticos que alteram a pressão ocular, como a depressão escleral e a transiluminação, bem como a realização de exames invasivos, disseminarem células tumorais pela manipulação(6).
As neoplasias melanocíticas uveais são classificadas segundo características histológicas, as quais podem ser importantes para o prognóstico quando se as considera em associação com o tamanho, localização e extensão extra-escleral do tumor(7). A classificação mais usada é a de Callender, de 1931(8), cuja base é a tipificação celular dos tumores, e cujo prognóstico pode variar entre melhor a pior.
Os melanomas malignos da coróide, podem fazer disseminação para fígado e para outros órgãos, a despeito do sucesso obtido com tratamento local e controle do crescimento tumoral. O tratamento pode, no entanto, influenciar o prognóstico se realizado enquanto o tumor ainda é pequeno(9). Várias são as opções de tratamento para o paciente portador de melanoma de coróide(10).
Para efeito, a decisão sobre o melhor método de tratamento dos melanomas de coróide, depende de vários fatores, entre os quais o tamanho do tumor, o padrão de crescimento, a acuidade visual em ambos os olhos, a idade e o estado geral do paciente. Em sendo assim, o tratamento recomendado deve resultar ao paciente o melhor prognóstico sistêmico e maior preservação de visão útil no olho afetado(3).
Contemporaneamente, os métodos terapêuticos disponíveis incluem observação, enucleação, exenteração da órbita, termoterapia, radioterapia, ressecção local do tumor, quimioterapia, imunoterapia e fotocoagulação, ou várias combinações desses.
Outro aspecto se refere a que, enquanto aos pequenos melanomas de coróide, é possível observá-los simplesmente, aos grandes tumores impõe-se a necessidade de enucleação ou mesmo exenteração; entretanto, apesar da existência de todos os métodos citados acima, o tratamento de tumores médios ainda permanece em discussão.
Para um bom acompanhamento do crescimento tumoral, há necessidade de documentação e medida do tamanho desses tumores. A ultra-sonografia estandartizada e a retinografia e angiografia fluorescente realizadas com o Imagenet ou com o Scanning Laser Ophthalmoscope são os exames complementares mais utilizados na avaliação do crescimento documentado dos melanomas de coróide.
Muito embora sejam métodos eficazes, tem custo elevado e são disponíveis apenas em alguns poucos centros de tratamento desses tumores em nosso meio.
O objetivo deste estudo é apresentar um modelo matemático simples e de baixo custo, para medida de áreas de lesões e/ou tumores do fundo de olho.
MÉTODOS
Este estudo experimental, foi executado no Doheny Eye Institute, Universidade do Sul da Califórnia, Los Angeles, CA, EUA.
Todos os procedimentos realizados seguiram fielmente as normas da Associação para Pesquisa em Visão e Oftalmologia - Association for Research in Vision and Ophthalmology - ARVO - para o uso de animais em pesquisas.
Para realização deste estudo, foram utilizados coelhos pigmentados, de cor marrom, do sexo masculino, com peso variando entre 3 a 4kg, sem sinais de doença, oriundos de uma fazenda especializada em criação de coelhos para pesquisa biomédica em Los Angeles (CA), EUA.
De cada animal, somente um dos olhos foi submetido à cirurgia. Os procedimentos foram realizados sob anestesia geral e tomaram-se plenas precauções no cuidado pós-operatório. À parte do grupo dos animais do experimento, 3 coelhos foram utilizados como doadores dos tumores, após implante na câmara anterior, como será descrito adiante.
O total de 25 olhos de 25 animais foram utilizados neste estudo. Todos os olhos foram submetidos à retinografia e angiografia fluoresceínica.
Os animais foram alojados em gaiolas individuais, no biotério do Centro de Pesquisas em Oftalmologia do Doheny Eye Institute, Universidade do Sul da Califórnia, Los Angeles (CA), EUA, e ali alimentados com ração rotina desse biotério, complementação dietética - cenouras e verduras - e água "ad libitum". Todos os coelhos foram mantidos em condições convencionais de laboratório, e submetidos a ciclos alternados de 12 horas no claro e 12 horas no escuro, para evitar o "stress" dos animais.
Os animais foram submetidos à anestesia geral, para os exames e tratamentos, com injeção intramuscular de uma mistura de cloridrato de ketamina na dose de 25mg/kg de peso e cloridrato de 2-(2,6-xilidino)-5,6-dihidro-4H-1,3-tiazina na dose de 5mg/kg de peso. A anestesia tópica foi realizada com instilação de 1 gota de colírio combinado de cloridrato de tetracaína, cloridrato de fenilefrina e ácido bórico.
1.1 Técnica operatória utilizada nos animais doadores para transplante dos tumores
Melanomas amelanóticos de hamster do tipo Greene, congelados em nitrogênio líquido e armazenados em criotubos, foram transferidos para uma placa de petri que continha solução salina isotônica. Dois ou 3 pequenos fragmentos do tumor foram sugados, juntamente com 0,2 ml da solução, para o interior de uma seringa de 2 ml com agulha de 20 gauge. Após anestesia, a solução salina contendo os fragmentos do tumor, foi injetada na câmara anterior por punção limbar - na região nasal ou temporal superior - no sentido horizontal. Após a injeção, os tumores boiaram livremente na câmara anterior até se fixarem na íris. Os tumores transplantados alcançaram o tamanho ideal para serem re-transplantados entre 7 e 14 dias(11).
1.2 Técnica operatória utilizada para implantes dos tumores no espaço supracoroídeo
Os animais doadores foram sacrificados, quando os tumores ocuparam metade do espaço da câmara anterior. Após anestesia, as córneas foram retiradas com incisão circular, e os tumores excisados com auxílio de tesouras estéreis e colocados em placa de petri, que continha solução salina isotônica. Os tumores foram cortados com lâmina de bisturi número 15 em pequenos fragmentos com aproximadamente 0,25 mm cada, para implante no espaço supracoroideo dos animais receptores. A técnica utilizada para a indução dos tumores foi a descrita por Krohn et al.(12). Os animais receptores não imunossuprimidos foram anestesiados, e cada um dos olhos de cada animal foi mantido aberto com auxílio de blefarostato. Com o uso de microscópio cirúrgico (Zeiss Co, Alemanha), uma peritomia desde a região temporal até a nasal inferior foi realizada, e suturas com fio de seda 7-0, através da episclera, foram colocadas com o objetivo de tracionar o olho superiormente. Uma incisão de 4 mm, paralela e distante 7 mm do limbo, foi realizada com uma lâmina de bisturi número 64 (Beaver Surgical Products, EUA). A incisão foi estendida por 3 mm posteriormente no espaço intra-escleral, com uma espátula de ciclodiálise, para formar uma pequena bolsa. Na parte terminal desta bolsa, a espátula foi direcionada internamente até alcançar o espaço supracoroideo onde se procedeu à dissecção. Um fragmento, de cada vez, do tumor, com aproximadamente 0,25 mm, foi aspirado com uma cânula curva de ponta romba de 22 gauge, juntamente com pequena quantidade de solução salina. Ato contínuo, a cânula foi inserida através da incisão até alcançar o espaço supra-coroideo onde o fragmento do tumor foi injetado. Para facilitar a avaliação, todos os tumores foram implantados, aproximadamente, a 2 diâmetros papilares e, inferiormente ao nervo óptico - "regio macularis" - em um dos olhos de cada animal. O posicionamento do implante tumoral foi verificado com oftalmoscopia indireta, e lente asférica de 28 dioptrias, sob midríase pupilar. Após remoção da cânula, o retalho escleral e a conjuntiva foram suturados com seda 7-0 e 8-0, respectivamente.
O crescimento dos tumores foi avaliado diariamente, após o implante, e todos eles alcançaram o tamanho de 3 a 4 diâmetros papilares entre o 6º a 10º dias após o implante.
1.3 Avaliação pós-operatória
Quando os tumores alcançaram 3 a 4 diâmetros papilares, sob oftalmoscopia indireta com lente condensadora asférica de 28 dioptrias, estavam então prontos para serem submetidos a exame (Figura 1). As retinografias foram realizadas com aparelho retinógrafo Kowa RC-XV (Kowa Inc., Japão), sem Imaginet, com ampliação de 20 graus, foco fixo e filme Kodak Ektachrome Asa 100 (Eastman Kodak Inc., EUA). Realizaram-se as angiografias fluoresceínicas, após injeções endovenosas de 0,5 ml de fluoresceína sódica a 10% (Ak-Fluor, Akorn, Inc., EUA) usando-se o aparelho retinógrafo Kowa RC-XV (Kowa Inc., Japão) com ampliação de 20 graus, com filme preto e branco Tri-X Pan Asa 50 (Eastman Kodak Inc., EUA). As fotografias foram realizadas imediatamente após a injeção de fluoresceína, 5 minutos e 10 minutos consecutivamente.
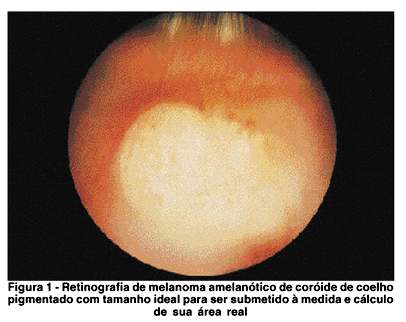
Cada grupo de olhos foi distribuído em subgrupos. O grupo C (controle) subdividido nos subgrupos C3, C7 e C14; o grupo L (olhos submetidos somente a fotocoagulação com laser de diodo), nos subgrupos L3, L7 e L14 e o grupo LICV (olhos submetidos a fotocoagulação com laser de diodo após injeção de indocianina verde), nos subgrupos LICV3, LICV7 e LICV14.
Considerou-se o dia 0 (zero) para se iniciar a avaliação dos grupos quando os tumores atingiram o tamanho de 3 a 4 diâmetros papilares.
1.4 Medidas das áreas dos tumores
Dos tumores obtiveram-se os "slides" de 35 mm com o retinógrafo sob foco fixo, conforme descrição anterior, os quais foram fixados um de cada vez, em um ergatoscópio com lâmpada fluorescente. Uma lente de +16 dioptrias foi adaptada a uma câmera de vídeo de alta resolução (Panasonic Inc, Japão), a qual foi posicionada de modo a se obter a melhor focalização da imagem do "slide". Esta câmera foi ligada a um aparelho de videocassete de alta resolução, que por sua vez estava conectado a um computador Apple Macintosh 7100 (Apple Macintosh Inc., EUA). Nas imagens, uma vez captadas e processadas pelo Dapple PrismView Software, delinearam-se com o "mouse" as bordas do tumor e se obtiveram os valores das áreas tumorais.
Por um coeficiente matemático determinou-se o índice de magnificação do tamanho do tumor no "slide" para o tamanho real do tumor, como descrito abaixo.
1.4.1 Determinação do índice de magnificação
Para cálculo do tamanho real do tumor, partiu-se da determinação do tamanho do nervo óptico no "slide". Utilizou-se o nervo óptico do coelho como padrão para a determinação do índice de magnificação, uma vez que o respectivo tamanho real é conhecido e cujo diâmetro mede aproximadamente 0,15 cm(13). Após a captação e projeção da imagem em computador com monitor de 18 polegadas, procedeu-se ao delineamento da imagem da cabeça do nervo óptico com o "mouse", ao que se intitulou área do nervo óptico na tela. Com o Dapple PrismView Software, programa de computador usado para este estudo, obteve-se o valor do tamanho da área da imagem delineada e a porcentagem, a que se chamou fração da área. A imagem integral captada, a que se deu o nome de área da imagem captada, houve-se projetada na tela do computador apenas parcialmente, onde o nervo óptico estava evidente.
A partir do exposto pôde-se obter o seguinte resultado:
1 - Área da imagem captada = 284,808.8714mm2
2 - Fração da área = 4,4585 %
3 - Área do nervo óptico na tela = 12,698.20353 mm2
Sabendo-se que o diâmetro do nervo óptico é aproximadamente a raiz quadrada da sua área, calculou-se que o diâmetro do nervo óptico que apareceu na tela do computador foi de 112,6863059 mm ou aproximadamente 11,27 cm.
Para verificar a relação entre o tamanho do tumor no "slide", e o tamanho do tumor na tela do computador, necessitou-se de um coeficiente de magnificação, obtido também com o "software". Como esta medida foi passível de imprecisão, foram tomadas 10 medidas do coeficiente de magnificação e a média daquelas 10 medidas foi adotada como coeficiente.
A partir do procedimento retro descrito obteve-se o seguinte resultado:
| Medidas: | |
| 1 - 211,579 mm/cm | 6 - 212,634 mm/cm |
| 2 - 212,642 mm/cm | 7 - 213,687 mm/cm |
| 3 - 213,695 mm/cm | 8 - 212,632 mm/cm |
| 4 - 213,695 mm/cm | 9 - 213,684 mm/cm |
| 5 - 210,537 mm/cm | 10 - 213,684 mm/cm |
| MÉDIA = 212,8469 mm/cm |
Este valor de 212,8469 mm/cm significou que cada cm, medido no "slide", foi representado por 212,8469 mm na tela do computador.
Então, o diâmetro do nervo óptico, mostrado na tela do computador cujo valor foi de 112,6863059 mm significou a representação do diâmetro do nervo óptico no "slide" que mediu 0,529424229 cm. Obteve-se tal valor da seguinte forma: (112,6863059mm/212,8469mm/cm) o qual representou uma área de 0,280290014 cm2.
Outra forma empregada para determinar o valor da área do nervo óptico no "slide" foi a divisão do valor da área do nervo óptico obtido na tela do computador, pelo quadrado do coeficiente de magnificação. Ao que se obteve o valor da área do nervo óptico no "slide" o qual foi o mesmo valor encontrado com os cálculos citados anteriormente, como mostra o exemplo abaixo:
A raiz quadrada de 0,280290014 cm2 é igual a 0,529424229cm que é o diâmetro do nervo óptico no "slide", e obtido anteriormente. Este cálculo foi utilizado como prova real.
Para efeito e de acordo com o estudo de Prince em 1964, sabe-se que a medida real do diâmetro do nervo óptico é de aproximadamente 0,15 cm. Pôde-se então, com essas informações, determinar o número de vezes que o diâmetro do nervo óptico é maior no "slide" em relação ao valor real do nervo óptico. Este valor é o índice de magnificação do "slide" em relação ao valor real do nervo óptico. Desta forma se 0,529424229 cm de diâmetro, no "slide", equivale a 0,15 cm, então 1 cm foi representado por:
Sendo assim, obteve-se no "slide" a imagem aumentada aproximadamente em 3,5 vezes em relação à estrutura real fotografada. De forma inversa, para se obter o valor do tamanho real do nervo óptico a partir da imagem no "slide", bastou dividir o valor obtido para o tamanho do nervo óptico no "slide" por 3,5294986cm, o que equivaleu a multiplicar o valor do tamanho do nervo óptico por 0,2833 (1/3,5294986cm). Este valor foi chamado de índice de magnificação para efeito de distinção com coeficiente de magnificação, utilizado na relação entre a área do "slide" e a área da tela do computador.
Para se trabalhar com valores de áreas, elevou-se ao quadrado o valor do índice de magnificação. O valor da área do nervo óptico no "slide" já havia sido calculada anteriormente e foi igual a 0,280290014cm2. Este valor foi multiplicado pelo quadrado do valor do índice de magnificação para se obter o valor da área real do nervo óptico, como se segue:
0,280290014cm2 x (0,2833)2 = 0,0227cm2
Então, 0,0227cm2, foi o valor da área real do nervo óptico e a sua raiz quadrada que foi igual a 0,1508cm ou 1,508mm representou o valor real do diâmetro do nervo óptico, como era esperado.
Para determinar as áreas reais dos tumores, o procedimento se deu analogamente àquele realizado para a área do nervo óptico, como descrito acima. Entretanto para entendimento dos resultados que se seguem, far-se-á breve resumo de como os resultados das medidas das áreas dos tumores foram obtidos:
De posse do "slide" com as fotografias dos tumores, o "software" utilizado forneceu a área da imagem correspondente ao tumor no "slide", a fração da área representativa do tumor na tela do computador e o coeficiente de magnificação do "slide" em relação à tela do computador. Como as medidas foram realizadas em dois dias diferentes, para cada conjunto de olhos foi determinado o valor médio do coeficiente de magnificação, de cada dia.
Ao se aplicar o valor das frações das áreas dos tumores nos valores das imagens, obtiveram-se os valores das áreas dos tumores na tela do computador. Esses valores das áreas, obtidos automaticamente com o "software", na tela do computador, foram divididos pelo coeficiente de magnificação, expresso em mm/cm, para se obter os valores das áreas dos tumores nos "slides".
Com o valor (0,2833)2 transformou-se o valor das áreas dos tumores, obtidos nos "slides", para a obtenção de suas respectivas áreas reais.
1.5 Análise estatística
A análise estatística, para a avaliação das áreas tumorais, foi realizada com o teste de variância ANOVA e se consideraram medidas estatisticamente significativas aquelas com p £ 0,01.
RESULTADOS
2.1 Determinação das áreas reais dos tumores
No Quadro 1 estão os valores obtidos da fração das áreas dos tumores na tela do computador, áreas correspondentes aos tumores na tela do computador, áreas dos tumores no "slide" e áreas reais dos tumores. As áreas dos tumores no "slide", em olhos dos animais de números 35, 17, 31, 24, 30, 39, 29, 32, 34, 26, 27, 9, 16, 43, 19 e 25, foram determinadas pela razão entre a área na tela do computador e o quadrado do coeficiente de magnificação que para este conjunto de olhos foi de 863,4631 mm/cm. As áreas dos tumores no "slide", em olhos dos animais de números 14, 3, 10, 38, 36, 23, 37, 41 e 42, foram determinadas pela razão entre a área na tela do computador e o quadrado do coeficiente de magnificação que para este conjunto de olhos foi de 193,9964 mm/cm.
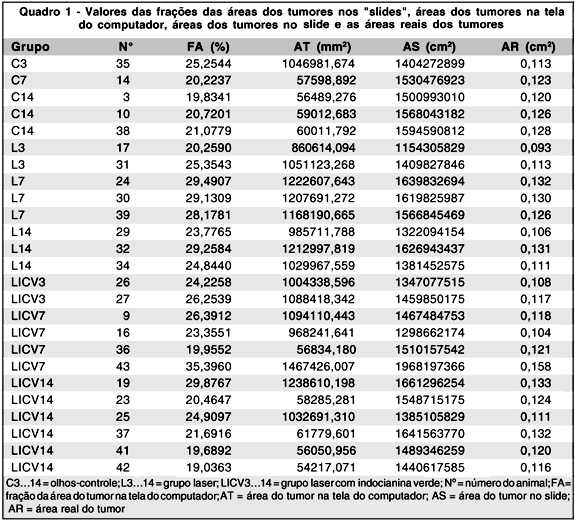
Estes valores retro apresentados foram multiplicados pelo índice de magnificação elevado ao quadrado, assim: (0,2833)2, o qual já houvera sido previamente obtido pelas medidas matemáticas do nervo óptico, e portanto, o tal índice (0,2833)2, reduziu os valores das áreas dos tumores nos "slides" para os valores reais das áreas dos tumores.
2.1.1 Comparação das áreas reais dos tumores entre os Grupos
Na Tabela 1 constam os valores das áreas reais dos tumores para os grupos C, L e LICV previamente ao início do tratamento a que seriam submetidos, ou seja, no dia 0 (zero). Para os tumores dos olhos dos subgrupos C3, C7 e C14 obtiveram-se os valores de 0,113cm2; 0,123cm2 e os de 0,120cm2, 0,126cm2, 0,128cm2, respectivamente. Para os tumores dos olhos dos subgrupos L3, L7 e L14 obtiveram-se os valores de 0,093cm2 e 0,113cm2; 0,132cm2, 0,130cm2 e 0,126cm2 e 0,106cm2, 0,131cm2 e 0,111cm2, respectivamente. Para os tumores dos olhos dos subgrupos LICV3, LICV7 e LICV14 obtiveram-se os valores de 0,108cm2, 0,117cm2; 0,118cm2, 0,104cm2, 0,121cm2 e 0,158 cm2 e 0,133cm2, 0,124cm2, 0,111cm2, 0,132cm2, 0,120cm2 e 0,116cm2, respectivamente.
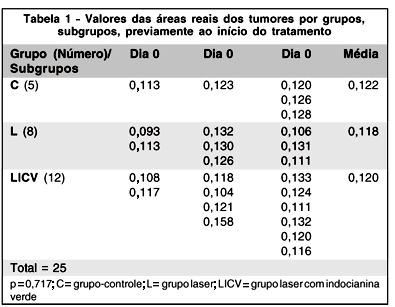
Com os dados da Tabela 1 e com a comparação dos valores das médias obtidas para os 3 grupos, verificou-se que não existiu diferença estatisticamente significativa entre eles (p= 0,717).
DISCUSSÃO
De uma amostra de 25 animais, escolheu-se usar, de cada animal, apenas um dos olhos para o experimento.
Foram selecionados coelhos adultos, com peso em torno de 3kg para facilitar as cirurgia de implante tumoral'os exames e a documentação fotográfica.
Escolheu-se o melanoma de Greene(14) como modelo tumoral, por ser amelanótico, de crescimento rápido e não necessitar de imunossupressão do animal para proliferação celular.
De todos os métodos disponíveis para o tratamento do melanoma de coróide, a enucleação parece não ser o melhor, principalmente em melanomas de tamanho médio, pela grande incidência de mortalidade, após o procedimento(15). Com base nestas afirmações, tratamentos alternativos, pelo menos tão efetivos quanto à enucleação, mas que protejam a vida humana com manutenção de olhos e de visão, se impõem. Contudo, há estudos para outros tratamentos os quais incluem: fotocoagulação(16-17), crioterapia(18), excisão local(19), ressecção tumoral em bloco(20), radioterapia(21), radioterapia térmica(22), quimioterapia(23), imunoterapia(24) e fotocoagulação com "excimer" laser(25). Destes, a radiação braquiterápica(26) e a radiação externa(27) são as mais freqüentemente utilizadas.
O controle documentado do crescimento tumoral, independente da forma de terapêutica utilizada, é de suma importância para verificação da eficácia do tratamento. Mais importante ainda é o controle daqueles tumores pequenos que são submetidos apenas à observação.
A análise dos resultados do presente estudo evidenciou que não houve diferença estatística entre as áreas dos tumores, em todos os olhos, no início do período de observação. Assim sendo, pode-se inferir que os tumores eram semelhantes em tamanho antes do início do tratamento a que seriam submetidos.
O desenvolvimento de novos equipamentos como o Confocal Scanning Laser Ophthalmoscope, que é capaz de realizar exames de angiografia com fluoresceína sódica e indocianina verde simultaneamente, possibilitou melhor estudo, não somente da área tumoral, como também da microcirculação de melanomas de coróide experimentais induzidos em coelhos(28) e em melanomas de coróide em humanos(29). Os padrões da microcirculação tumoral são os mesmos encontrados na histopatologia, os quais são: em rede, paralelo com ou sem cruzamento e silencioso. Nesses dois estudos verificaram-se que imagens "in vivo" dos diferentes padrões da microcirculação tumoral, oferecem a possibilidade de se prognosticar os melanomas de coróide, sem necessidade de remoção tecidual para exame histopatológico. Esses trabalhos abrem a possibilidade para realização de futuros estudos com o objetivo de verificar se os diferentes padrões da microcirculação tumoral influenciam nos vários tipos de tratamento utilizados atualmente.
É importante salientar que o método simples apresentado neste estudo, para a documentação e medida de áreas de tumores do fundo de olho, pode auxiliar o acompanhamento do crescimento tumoral documentado de tumores pequenos que são submetidos à observação apenas. Além disso, pode auxiliar no controle documentado do crescimento de tumores submetidos às várias opções terapêuticas existentes atualmente.
A ultra-sonografia estandartizada é o exame ideal para a medida da altura dos tumores(16), enquanto que a medida das áreas tumorais com o método proposto neste estudo, pode verificar a extensão e crescimento lateral de lesões tumorais.
Concluiu-se neste estudo, que com o uso de retinógrafo sem Imaginet, foi possível medir "in vivo", com acurácia e segurança, através de cálculo matemático, a área de melanomas amelanóticos de hamster implantados no espaço supra-coroídeo de coelhos. A medida das áreas dessas lesões tumorais foi importante para o controle inicial de tumores que foram submetidos a tratamento somente com laser de diodo e laser de diodo potencializado pela indocianina verde, cujos resultados serão publicados posteriormente.
REFERÊNCIAS
1. Boring GC, Squires TS, Tong T. Cancer statistics. 1991. CA Cancer J Clin 1991;41:19-36, Erratum In: CA Cancer J Clin 1991;41:111.
2. Strickland D, Lee JA. Melanomas of eye: stability of rates. Am J Epidemiol 1981;113:700-02.
3. Shields JA, Shields CL. - Management of posterior uveal melanoma. In: Shields JA, Shields CL. Intraocular tumors. A text and atlas. Philadelphia: Saunders;1992. p.171-205.
4. Lucas DR. Greer's ocular pathology. 4. ed. New York: Blackwell Scientific; 1990.
5. Grin-Jorgensen C, Berke A, Grin M. Ocular melanoma. DermatolClin North Am 1992;10:663-8.
6. Fraunfelder FT, Boozman III FW, Wilson RS, Thomas AH. No-touch technique for intraocular malignant melanomas. Arch Ophthalmol 1977; 95:1616-20.
7. Shammas hF, Blodi FC. Orbital extension of choroidal and ciliary body melanomas. Arch Ophthalmol 1977;95:2002-5.
8. Calender GR. - Malignant melanotic tumors of the eye: a study of histologic types in 111 cases. Trans Am Acad Ophthalmol Otolaryngol 1931;36:131.
9. Shields JA, Shields CL, De Potter P, Singh AD. Diagnosis and treatment of uveal melanoma. Semin Oncol 1996;23:763-7.
10. Shields JA, Shields CL, Donoso LA. Management of posterior uveal melanomas. Surv Ophthalmol 1991;36:161-95.
11. Chong LP, Özler SA, De Queiroz, Jr. JM, Liggett PE. Indocyanine green-enhanced diode laser treatment of melanoma in a rabbit model. Retina 1993; 13:251-9.
12. Krohn S, Brandt R, Norris DA, Keston AS. Subchoroidal transplantation of an experimental malignant melanoma. Am J Ophthalmol 1970;70:573-6.
13. Prince JH. The rabbit eye in research. Springfield: Thomas C. Publisher; 1964.
14. Greene HSN. A spontaneous melanoma in the hamster with a propensity for amelanotic alteration and sarcomatous transformation during transplantation. Cancer Res 1958;18:422-5.
15. Zimmerman LE, McLean IW, Foster WD. Does enucleation of the eye containing a malignat melanoma prevent or accelerate the dissemination of tumor cells? Br J Ophthalmol 1978;62:420-5.
16. Foulds WS, Damato BE. Low-energy long-exposure laser therapy in the management of choroidal melanoma. Graefes Arch Clin Exp Ophthalmol 1986;224:26-31.
17. Bornfeld N, Wessing A - Photocoagulation of choroidal melanoma. In: Ryan SJ. editors. Retina. St. Louis: CV Mosby; 1989. p.721-7.
18. Lincoff H, McLean J, Long R. The cryosurgical treatment of intraocular tumors. Am J Ophthalmol 19. Foulds WS. Experience of local excision of uveal melanomas. Trans Ophthalmol Soc 1977;97:412-5.
20. Moreira Jr CA, Ramos ARB, Wahab AS, Santos FS. Ressecção cirúrgica em bloco de melanoma maligno de coróide. Arq Bras Oftalmol 1996;59:88-91.
21. Char DH, Castro JR, Kroll SM, Irvine AR, Quivey JM, Stone RD. Five-year follow-up of helium ion therapy for uveal melanoma. ArchOphthalmol 1990; 108:209-14.
22. Finger PT, Packer S, Svitra PP, Paglione RW, Anderson LL, Kim JH et al. Thermoradiotherapy for intraocular tumors. ArchOphthalmol 1985;103:1574-8.
23. Olsen KR, Blumenkranz M, Hernandez E, Hajek A, Hartzer M. Fluorouracil therapy of intraocular greene melanoma in the rabbit. Arch Ophthalmol 1988; 106:812-5.
24. Currie G. Is there a role for immunotherapy in the treatment of human cancer? TransOphthal Soc 1977;97:442-4.
25. Mieler WF, Chilbert M, Willians GA. Endoexcimer ablative photodecomposition of choroidal melanoma in a rabbit model [abstract]. Invest OphthalmolVisSci 1987;28 Suppl:117.
26. Augsburger JJ, Gamel JW, Shields JA. Cobalt plaque radiotherapy versus enucleation for posterior uveal melanoma: comparison of survival by prognostic index groups. Trans Am Ophthalmol Soc 1989;87:348-61.
27. Seddon JM, Gragoudas ES, Albert DM. - Ciliary body and choroidal melanomas treated by proton beam irradiation: histopathologic study of eyes. Arch Ophthalmol 1983;101:1402-8.
28. Mueller AJ, Folberg R, Freeman WR, Bartsch DU, Bergeron-Lynn G, Mehaffey MG, Kan-Mitchell J, Huang X, Jian G, Avila C, Taskintuna I, Cheng L, Wang J. Evaluation of the human choroidal melanoma rabbit model for studying microcirculation patterns with confocal ICG and histology. Exp Eye Res 1999;68:671-8.
29. Mueller AJ, Freeman WR, Folberg R, Bartsch DU, Scheider R A, Schaller U, Kampik A.- Evaluation of microvascularization pattern visibility in human choroidal melanomas: comparison of confocal fluorescein with indocyanine green angiography. Graefes Arch Clin Exp Ophthalmol 1999;237:448-56.
* Este estudo é parte integrante da Tese de Doutorado Intitulada "Indocianina Verde Como Agente Potencializador do Laser de Diodo no Tratamento de Melanoma de Coróide em Coelhos", defendida no Departamento de Oftalmologia da Escola Paulista de Medicina - Universidade Federal de São Paulo, que foi desmembrada para fins de publicação.
1 Mestre e Doutor em Clínica Cirúrgica pela Universidade Federal do Paraná e Doutor em Oftalmologia pela Escola Paulista de Medicina –Universidade Federal de São Paulo.
2 Professor e Chefe do Departamento de Estatística da Universidade Federal do Paraná.
3 Médico do Serviço de Oftalmologia do Hospital Regional de São José - SC.
4 Professor Titular de Oftalmologia e Chefe do Setor de Ciências da Saúde da Universidade Federal do Paraná.
5 Associate Professor of the Doheny Eye Institute - University of Southern California.
Endereço para correspondência: Rua Dep. Leoberto Leal 14 – Florianópolis (SC) CEP 88015-080.
E-mail: [email protected]
Recebido para publicação em 25.07.2001
Aceito para publicação em 02.04.2002
Nota editorial: Pela análise deste trabalho e por sua anuência sobre a divulgação desta nota, agradecemos à Dra. Mariza Toledo de Abreu.