

Jarbas Pereira de Macedo1; Adriana dos Santos Forseto2; Norma Allemann3; Luciene Barbosa de Sousa4
DOI: 10.1590/S0004-27492009000400010
RESUMO
OBJETIVO: Avaliar a eficácia e as complicações da técnica de ceratoplastia lamelar anterior profunda com dissecção a ar no ceratocone, além dos achados da microscopia confocal. MÉTODOS: Dezessete olhos com ceratocone avançado foram submetidos à técnica supracitada. Após o procedimento cirúrgico, foram avaliadas a acuidade visual e as complicações tanto intraoperatórias quanto pós-operatórias. As espessuras corneana total, da córnea receptora, do botão doado e a interface doador-receptora foram avaliadas pela microscopia confocal. RESULTADOS: Obteve-se acuidade visual corrigida com óculos maior ou igual a 0,5 em 50% dos olhos. Foram observadas complicações intraoperatórias, como perfuração de membrana de Descemet, quanto pós-operatórias, como hipertensão ocular, crescimento epitelial e rejeição estromal, que atingiram 5 dos 17 pacientes (29,41%). Em 4 pacientes foi observada, pela microscopia confocal, a presença de estruturas hiperrefletivas na interface, sugestivas de depósitos e estrias. A média dos valores encontrados das paquimetrias corneana total, do botão doado e da córnea receptora foram de 609,00 ± 77,55 µm de 516,55 ± 43,65 µm e de 92,50 ± 60,10 µm respectivamente. CONCLUSÃO: Apesar de tecnicamente mais complexa, com risco de perfuração intraoperatória da membrana de Descemet, a técnica de ceratoplastia lamelar anterior profunda com dissecção a ar apresenta-se como opção de tratamento em casos de ceratocone. A microscopia confocal mostrou-se um método útil tanto na medida da paquimetria pós-operatória quanto na avaliação da interface, ao evidenciar ausência de opacidades na maioria dos casos.
Descritores: Córnea; Transplante de córnea; Ceratocone; Complicações pós-operatórias; Microscopia confocal; Procedimentos cirúrgicos oftalmológicos
ABSTRACT
PURPOSE: To evaluate the efficacy, complications and confocal microscopy corneal features of deep anterior lamellar keratoplasty using the air dissection technique in keratoconus. METHODS: Seventeen eyes with advanced keratoconus were submitted to this technique. Postoperative visual acuity and complication rate were analyzed. The thicknesses of full cornea tissue, host bed and donor button were measured, donor-host interface was also evaluated using confocal microscopy. RESULTS: Best-spectacle corrected visual acuity was 0.5 or better in 50% of the eyes. Complications occurred in five of seventeen patients (29.41%). Confocal microscopy demonstrated in four eyes the presence of hiperreflective structures at the interface, suggesting deposits and striae. Average corneal pachymetry, donor button and host bed thicknesses were respectively 609.00 ± 77.55 µm, 516.55 ± 43.65 µm and 92.50 ± 60.10 µm. CONCLUSIONS: Although technically challenging with the risk of intraoperative Descemet's membrane perforation, deep anterior lamellar keratoplasty with air dissection technique presents as an option for keratoconus treatment. Confocal microscopy demonstrated to be a useful method not only for the pachymetry measurement but also for the evaluation of interface by observing the absence of opacities in most of the cases.
Keywords: Cornea; Corneal transplantation; Keratoconus; Postoperative complications; Microscopy, confocal; Ophthalmologic surgical procedures
INTRODUÇÃO
Ceratoplastia lamelar anterior profunda (CLAP) é uma técnica que consiste em remover epitélio, camada de Bowman e estroma da córnea até atingir a membrana de Descemet (MD), deixando o endotélio inalterado. Esta apresenta a vantagem de eliminar a complicação de rejeição endotelial, que é considerada uma das mais importantes complicações da ceratoplastia penetrante (CP), além de reduzir as complicações intraoperatórias como sinéquia anterior, glaucoma e descolamento de coróide(1).
A CP consagrou-se como uma técnica cirúrgica com bons resultados visuais no pós-operatório de pacientes com ceratocone uma vez que a maioria atinge acuidade visual melhor ou igual a 0,5 depois de submetidos à referida técnica(2-5). Porém, estudos de CP em pacientes com ceratocone relatam incidência de rejeição de 20%, que pode levar à falência do botão transplantado(6-7).
Dentre as técnicas desenvolvidas para execução da CLAP, uma delas propõe a dissecção até o estroma profundo seguida de injeção de viscoeslástico para separação da MD. Logo após a dissecção, é realizada a remoção do estroma remanescente(8).
Alguns autores utilizaram solução salina para ceratectomia profunda após a dissecção manual superficial do estroma(9).
Porém, outro estudo desenvolveu a técnica de dissecção do estroma profundo com viscoeslástico tendo como plano de referência a interface ar-endotélio, criada pela injeção de ar na câmara anterior(10).
Tsubota e colaboradores propuseram a técnica de "dividir e conquistar" à CLAP. Depois da trepanação da córnea receptora, procede-se a injeção de ar e solução salina para dissecção do estroma profundo, dividindo-o em quatro quadrantes para remoção das camadas estromais(11).
Anwar et al. desenvolveram a técnica de "big-bubble" em que, após a trepanação da córnea receptora numa profundidade de 400 µm, é feita a injeção de ar no estroma paracentral. Forma-se então uma grande bolha de ar entre a MD e o estroma criando assim um plano de clivagem para ceratectomia lamelar anterior seguida da retirada do estroma profundo com espátula de íris(12).
Outra técnica descrita é a que utiliza um microcerátomo com avanço manual para o preparo da córnea receptora e uma câmara anterior artificial para preparo da córnea doada(13).
Recentemente, foi desenvolvido o "laser" de femtosegundo para confecção das lamelas doadoras e receptoras, possibilitando a criação de um leito estromal mais uniforme(14).
Assim, o objetivo deste estudo foi avaliar a eficácia e as complicações da técnica de CLAP manual com dissecção a ar em pacientes portadores de ceratocone, além dos resultados da microscopia confocal.
MÉTODOS
Foram incluídos neste estudo prospectivo não comparativo 17 olhos de 17 pacientes. A técnica empregada baseou-se na descrita por Anwar, porém com algumas modificações uma vez que foi realizada a dissecção com ar do estroma profundo sem a formação da grande bolha ou "big-bubble", como preconiza a técnica original.
O critério de inclusão foi a seleção de pacientes com diagnóstico de ceratocone avançado (ceratometria máxima maior que 52 dioptrias pela topografia) e com acuidade visual com lente de contato menor ou igual a 0,3. Pacientes com cicatrizes estromais foram excluídos do trabalho.
Todos os pacientes foram submetidos ao exame oftalmológico que consistiu em biomicroscopia, tonometria de aplanação de Goldman, oftalmoscopia binocular indireta, teste de adaptação para lente de contato, potencial visual pelo PAMTM e topografia. Um paciente tinha sido submetido à retinopexia e outro era portador de ambliopia.
O estudo foi aprovado pelo Comitê de Ética do Hospital Oftalmológico de Sorocaba e consentimento informado foi obtido de todos os pacientes.
Cada paciente foi examinado no primeiro, sétimo, trigésimo dia após cirurgia e mensalmente até o fim do seguimento.
Em toda avaliação, foram realizadas medida da acuidade visual com correção (AV c/c), biomicroscopia e tonometria. No terceiro mês de pós-operatório os pacientes foram submetidos à avaliação pela microscopia confocal para obtenção de: paquimetrias corneana total, do botão doado e da córnea receptora, além da avaliação da interface doador-receptor.
Técnica cirúrgica
Todos os pacientes, após a anestesia local peribulbar com cloridrato de ropivacaína 1%, foram submetidos ao procedimento cirúrgico pelo mesmo cirurgião experiente em CP, considerando os seguintes passos: assepsia com iodopovidona 10% na pele periocular e instilação de iodopovidona 5% na conjuntiva; trepanação da córnea receptora com diâmetro médio de 8,00 mm até região pré-MD; injeção de ar com agulha 13 x 4,5 mm; dissecção do estroma profundo com espátula de íris em quatro quadrantes; ceratectomia lamelar até a MD; trepanação da córnea doada, sem remoção do endotélio e MD, com o mesmo diâmetro da receptora; paracentese com injeção de miostático; sutura de espessura total da córnea doada à receptora com 16 pontos separados com mononylon 10.0; injeção subconjuntival de garamicina 2% associada à dexametasona 0,002%.
Os pacientes foram tratados com medicação tópica: acetato de prednisolona 1% oito vezes ao dia na primeira semana de pós-operatório com retirada progressiva até o trigésimo dia. Gatifloxacino 0,3% foi usado topicamente nos sete primeiros dias até epitelização completa do botão doador. A retirada de pontos foi feita a partir do terceiro mês baseada na refração dinâmica.
Microscopia confocal
Utilizou-se o aparelho de microscopia confocal ConfoScan® 2 (Fortune Technologies, Itália). Todos os exames foram realizados pelo mesmo profissional. O paciente foi posicionado em frente ao equipamento e orientado a manter o olhar fixo durante a realização do exame, evitando piscar. Uma gota de ácido poliacrílico 0,2% foi colocada sobre a lente objetiva de imersão, de forma a evitar o contato direto desta com a córnea do paciente. Após a instilação de colírio anestésico, com auxílio de um "joystick", prosseguiu-se a movimentação da lente por sobre a córnea do paciente até a localização da região a ser examinada (região central). Depois de focalizada esta região por meio do monitor do computador iniciou-se a gravação do exame e a captura das imagens foi realizada no modo automático permitido(15-16).
Neste equipamento, cada sequência permite a gravação de no máximo 350 imagens digitalizadas da córnea, sendo cada imagem correspondente a uma área de 330 x 440 mm, com aumento aproximado de 500 a 600 vezes. Pode-se realizar o rastreamento de todas as camadas da córnea, desde o endotélio até a região epitelial. O rastreamento da córnea com o microscópio confocal permite a construção de um gráfico de profundidade, sendo possível a localização relativa de determinada imagem em relação ao ponto inicial de captura (Z-Scan) (Figura 1). As diferentes camadas da córnea podem ser localizadas neste gráfico por possuírem refletividades diferentes: o endotélio apresenta maior refletividade, seguido pela região epitelial e por último pelo estroma. Por meio deste gráfico pode-se também medir a espessura (paquimetria óptica) de diferentes camadas da córnea. Foram selecionadas as melhores sequências de exame para o cálculo das espessuras, baseadas na melhor refletividade de cada camada corneana.
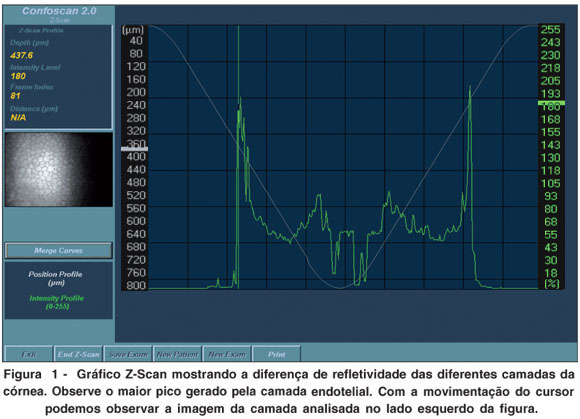
A análise descritiva dos dados composta pela média, mediana, desvio padrão e variação mínima a máxima foi feita pelo Microsoft Excel 2007®.
RESULTADOS
Os pacientes foram acompanhados por um período médio de 12,3 ± 2,4 meses de seguimento (variando de 3 a 14 meses).
Complicações
A técnica cirúrgica foi completada em todos os 17 pacientes. Em 2 pacientes (11,76%) houve perfuração da MD durante a dissecção estromal no eixo visual, porém foi possível finalizar o procedimento. Um destes evoluiu com boa transparência corneana em todo pós-operatório, porém o outro (5,88%) evoluiu com descolamento da MD e descompensação do botão, tendo sido indicada CP no 14º dia de pós-operatório com sua exclusão do estudo. Um paciente (5,88%) apresentou midríase fixa no primeiro dia de pós-operatório com hipertensão ocular e foi medicado sistemicamente, com controle da pressão intraocular logo na primeira semana. Este mesmo caso evoluiu com crescimento epitelial na interface no terceiro mês de pós-operatório, porém mantendo a transparência e a midríase do botão por todo o seguimento. Dois casos (11,76%) apresentaram rejeição estromal no terceiro mês de pós-operatório e responderam bem ao tratamento com corticóide tópico, evoluindo com transparência corneana. Um destes evoluiu com aumento de pressão intraocular após a corticoterapia, porém foi controlada com hipotensor tópico. Considerando esses 5 pacientes acima citados, conclui-se que o índice geral de complicações foi de 29,41% (5/17). Os demais pacientes não apresentaram complicações ao longo do seguimento.
Acuidade visual com correção
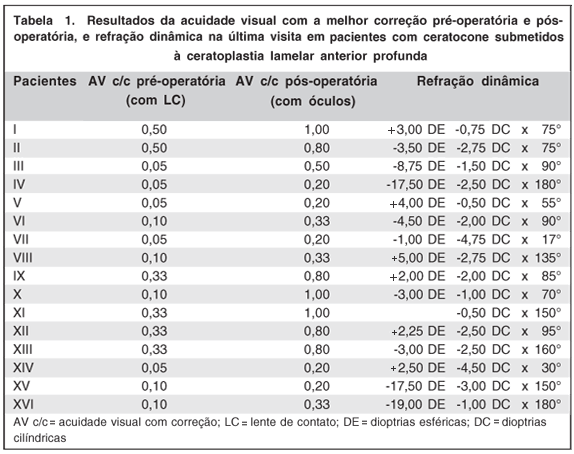
A AV c/c por óculos (n=16) teve média de 0,55 ± 0,34 (variando de 0,20 a 1,00; mediana de 0,50). Oito olhos (50%) obtiveram AV c/c maior ou igual a 0,50 (Tabela 1).
Refração dinâmica
Os dados da refração dinâmica encontram-se na tabela 1. O astigmatismo médio induzido foi de 2,15 ± 1,28 dioptrias cilíndricas.
Microscopia confocal
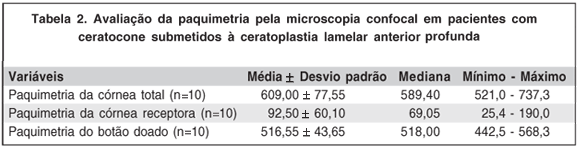
Quatro dos 16 pacientes não compareceram para realizar o exame. Em 2 dos 12 pacientes submetidos ao exame não foi possível avaliar a paquimetria por dificuldades técnicas, portanto considerou-se o cálculo da paquimetria em 10 casos.
A média da paquimetria corneana total foi de 609,00 ± 77,55 µm (Tabela 2). A média da paquimetria do botão doado, que foi considerado como sendo da interface até a superfície, foi de 516,55 ± 43,65 µm ± (Tabela 2). A paquimetria da córnea receptora apresentou média de 92,5 ± 60,1 (Tabela 2).
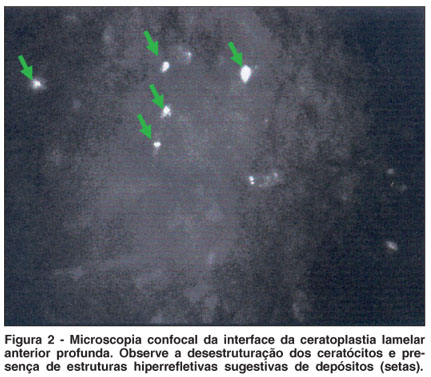
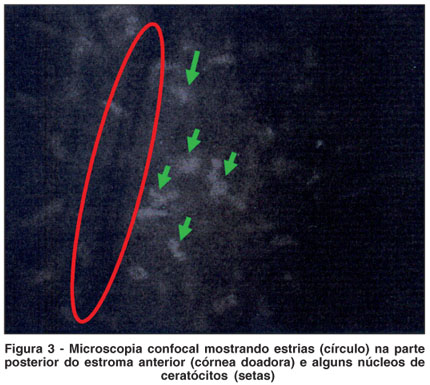
Em relação à avaliação da interface, em 4 pacientes foi observada a presença de estruturas hiperrefletivas na interface, sugestivas de depósitos (Figura 2) e estrias (Figura 3). Os demais pacientes não apresentaram alterações na interface. Dos 4 pacientes com depósitos na interface, 2 ficaram com AV c/c maior que 0,5 e 2 ficaram com AV c/c menor que 0,5. Portanto não houve correlação entre AV c/c e depósitos na interface (Tabela 3).
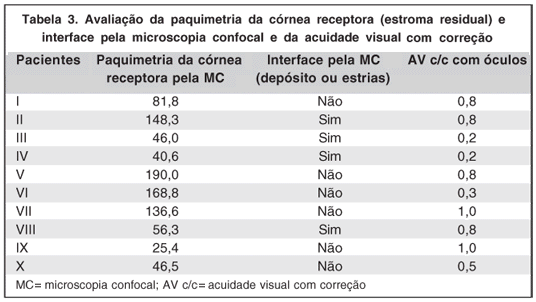
Também não houve correlação entre a paquimetria da córnea receptora e AV c/c uma vez que tanto no grupo de AV c/c maior que 0,5 houve pacientes com maior ou menor espessura de estroma residual quanto no grupo de AV c/c menor que 0,5 houve pacientes com maior ou menor espessura de estroma residual (Tabela 3).
DISCUSSÃO
Considerando a paquimetria feita pela MC, a literatura mostra que a aferição feita por este método apresenta menores valores em relação à paquimetria ultrassônica(17-19), podendo chegar a 7% de diferença(17). O referido método tem se mostrado preciso, não invasivo e reprodutível na aferição da paquimetria central(19).
Contudo, a grande limitação da paquimetria da MC em relação à paquimetria ultrassônica tem sido a falta de precisão devido ao tempo gasto no rastreamento da córnea e também o movimento da córnea no sentido ântero-posterior, que pode causar erros de aferição(19), como aconteceu em dois dos nossos casos em que não foi possível avaliar a paquimetria. Tecnicamente, faz-se necessária uma perfeita colaboração do paciente durante a aquisição das imagens, de forma a não movimentar os olhos, permitindo assim a reprodutibilidade dos valores obtidos daquela região. É importante ressaltar que a paquimetria ultrassônica, que é o método considerado padrão ouro na aferição da paquimetria central, também apresenta desvantagens devido ao posicionamento do paquímetro no centro da córnea ser examinador dependente, além do risco de infecção por ser uma técnica de contato direto(19).
No presente estudo, a técnica cirúrgica foi executada objetivando deixar a menor quantidade de estroma residual para permitir uma melhor AV c/c. Através de uma dissecção manual profunda feita pela injeção de ar seguida da ressecção estromal foi deixado um leito estromal residual de 92,5 ± 60,1 µm atingindo uma AV c/c média final de 0,55 ± 0,34. Outras publicações evidenciaram paquimetria de estroma residual de 65,50 ± 28,74 µm(20) e 64,2 ± 67,0 µm(21). Porém, não há muitos trabalhos na literatura correlacionando AV com paquimetria de estroma residual.
No presente estudo, não houve correlação entre acuidade visual e alterações na interface detectadas pelo MC, uma vez que dos 4 pacientes com depósitos na interface, 2 ficaram com AV c/c maior que 0,5 e 2 ficaram com AV c/c menor que 0,5 (Tabela 3). Em relação à paquimetria da córnea receptora, tanto no grupo com AV c/c maior que 0,5 quantos no menor que 0,5, houve pacientes com maior ou menor quantidade de estroma residual (Tabela 3). Portanto não houve correlação entre AV c/c e estroma residual.
Em uma publicação sobre CLAP, foi verificado pela MC paquimetria média da córnea receptora de 64,2 ± 67,0 µm (variação de 45 a 72 µm) no15º dia de pós-operatório e não houve diferença significante ao longo do seguimento de 12 meses(21), atingindo AV c/c final logarítmica (logMAR) de 0,104 ± 0,068. Foi também constatada correlação negativa entre a hiperrefletividade da interface e a melhor AV c/c, sendo que a microscopia confocal mostrou-se precisa na avaliação das camadas corneanas e da interface. Neste mesmo estudo, não foram feitas as medidas das paquimetrias corneanas total nem do botão doado. Não foram encontradas na literatura referências quanto às medidas das paquimetrias corneanas total nem do botão doado em pós-operatório de CLAP.
Numa série retrospectiva comparativa entre pacientes submetidos à CP e a CLAP correlacionando função visual com paquimetria corneanas medida pela tomografia de coerência óptica foi evidenciada AV c/c estatisticamente significante melhor nos olhos pós-CP(22). Foi constatado também que nos olhos pós-CLAP a AV c/c estava relacionada à paquimetria da córnea receptora. Olhos em que esta paquimetria foi menor que 20 µm a AV c/c foi similar aos olhos pós-CP enquanto que aqueles que tiveram a referida paquimetria maior do que 80 µm, a AV c/c foi estatisticamente significante pior. Os outros parâmetros avaliados, que foram a sensibilidade ao contraste e aberrometria, não apresentaram diferença estatisticamente significante comparando-se as duas técnicas. Estes dados sugerem que o principal parâmetro para boa função visual na CLAP em ceratocone é a paquimetria do leito estromal receptor residual.
Comparando a CP com a CLAP, Shimazaki e colaboradores observaram, num estudo comparativo entre as duas técnicas, diminuição progressiva da contagem endotelial nos primeiros 24 meses de pós-operatório de CP enquanto que no grupo submetido à CLAP a perda endotelial ocorreu até os seis meses e depois se estabilizou(23). Porém, foi observado que a lesão endotelial também pode ocorrer na CLAP, principalmente nos casos de ruptura intraoperatória de MD. O grupo da CLAP também se mostrou superior por ter menor aumento de pressão intraocular. Em relação à AV c/c, não houve diferença estatística entre os dois grupos.
Ao analisarmos na literatura trabalhos sobre CP em ceratocone verifica-se que o índice de pacientes que atinge AV c/c maior ou igual a 0,5 varia de 73,2%(3) a 91,7%(2,4-6), atingindo melhor AV se comparada à CLAP. Porém, a contagem endotelial pós-CP diminui em até dez anos numa taxa sete vezes maior que a da população normal e a incidência de rejeição endotelial gira em torno de 21%, aumentando assim o risco de falência tardia(7).
Já a CLAP possibilita a melhora visual sem o risco de rejeição endotelial. Outro aspecto importante, principalmente em países com escassez de doações de córneas, é a utilização de córneas tectônicas uma vez que a técnica é aplicada às doenças sem lesão endotelial(23). Vale ressaltar ainda a maior resistência ao trauma e o menor risco de complicações intraoperatórias(1). Contudo, a perfuração intraoperatória de MD, que é a principal complicação da CLAP, pode levar à descompensação endotelial.
No presente estudo, a incidência de rejeição estromal foi de 11,76%, comparável à outra série, cuja incidência foi de 9,6%(24).
No presente estudo, a média de AV c/c de 0,55 é comparável aos outros trabalhos da literatura, que relata valores de 0,38(11), 0,47(25) e 0,66(26). Um aspecto importante é que a nossa avaliação da AV foi feita somente com óculos e a literatura evidencia melhora importante da AV após adaptação de lente de contato após o transplante de córnea(27-28), o que pode justificar a AV c/c menor que 0,5 em metade dos pacientes.
Em relação às complicações, deve-se levar em consideração que o cirurgião do presente estudo tinha grande experiência na CP, porém estava iniciando sua curva de aprendizado na CLAP. Mesmo assim, a incidência de ruptura de MD, que foi de 11,8%, é comparável à da literatura, cuja incidência varia de 9%(12) a 15%(23,29-30). Foi possível realizar a técnica em 100% dos pacientes enquanto que em outra série utilizando a mesma técnica esse índice foi de 69,2%(30).
Considerando que o cirurgião estava iniciando sua curva de aprendizado na CLAP e que os resultados tanto de AV quanto de complicações são comparáveis aos da literatura, os resultados deste estudo podem ter significância clínica para futuras publicações.
CONCLUSÃO
Apesar de tecnicamente mais complexa, com risco de complicações intraoperatórias como perfuração da MD, a técnica de CLAP apresenta-se como opção de tratamento em casos de ceratocone. A microscopia confocal foi um método útil tanto na medida da paquimetria pós-operatória quanto na avaliação da interface doador-receptor, ao evidenciar a ausência de opacidades na maioria dos casos.
REFERÊNCIAS
1. Caporossi A, Balestrazzi A, Simi C, Caporossi T, Traversi C. Manual deep lamellar keratoplasty: alternative methods and air-guided technique. Transplant Proc. 2005;37(6):2697-701.
2. Zadok D, Schwarts S, Marcovich A, Barkana Y, Morad Y, Eting E, Avni I. Penetrating keratoplasty for keratoconus: long-term results. Cornea. 2005;24(8): 959-61.
3. Pramanik S, Musch DC, Sutphin JE, Farjo AA. Extended long-term outcomes of penetrating keratoplasty for keratoconus. Ophthalmology. 2006;113(9):1633-8. Comment in: Ophthalmology. 2007;114(10):1952; author reply 1953.
4. Koralewska-Mákar A, Flóren I, Stenevi U. The results of penetrating keratoplasty for keratokonus. Acta Ophthalmol Scand. 1996;74(2):187-90.
5. Lim L, Pesudovs K, Coster DJ. Penetrating keratoplasty for keratoconus: visual outcome and success. Ophthalmology. 2000;107(6):1125-31.
6. Kirkness CM, Ficker LA, Steele AD, Rice NS. The success of penetrating keratoplasty for keratoconus. Eye. 1990;4(Pt 5):673-88.
7. Ing JJ, Ing HH, Nelson LR, Hodge DO, Bourne WM. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology. 1998;105(10):1855-65.
8. Francesconi CM, Forseto AS, Nose RM, Nose W. Ceratoplastia lamelar profunda com viscodissecção da membrana de Descemet. Arq Bras Oftalmol. 2001; 64(5):385-8.
9. Sugita J, Kondo J. Deep lamellar keratoplasty with complete removal of pathological stroma for vision improvement. Br J Ophthalmol. 1997;81(3): 184-8.
10. Melles GR, Lander F, Rietveld FJ, Remeijer L, Beekhuis WH, Binder PS. A new surgical technique for deep stromal, anterior lamellar keratoplasty. Br J Ophthalmol. 1999;83(3):327-33.
11. Tsubota K, Kaido M, Monden Y, Satake Y, Bissen-Miyajima H, Shimazaki J. A new surgical technique for deep lamellar keratoplasty with single running suture adjustment. Am J Ophthalmol. 1998;126(1):1-8.
12. Anwar M, Teichmann KD. Big-bubble technique to bare Descemet's membrane in anterior lamellar keratoplasty. J Cataract Refract Surg. 2002;28(3): 398-403. Comment in: J Cataract Refract Surg. 2002;28(12):2067; author reply 2067-8.
13. Maia NCF, Chamon W, Castelo Branco B. Avaliação da exequibilidade, eficácia e segurança do transplante lamelar semi-automatizado de córnea. Arq Bras Oftalmol. 2006;69(6):795-804.
14. Sarayba MA, Maguen E, Salz J, Rabinowitz Y, Ignacio TS. Femtosecond laser keratome creation of partial thickness donor corneal buttons for lamellar keratoplasty. J Refract Surg. 2007;23(1):58-65.
15. Cavanagh HD, El-Agha MS, Petroll WM, Jester JV. Specular microscopy, confocal microscopy, and ultrasound biomicroscopy: diagnostic tools of the past quarter century. Cornea. 2000;19(5):712-22.
16. Kaufman SC, Musch DC, Belin MW, Cohen EJ, Meisler DM, Reinhart WJ, et al. Confocal microscopy: a report by the American Academy of Ophthalmology. Ophthalmology. 2004;111(2):396-406. Erratum in: Ophthalmology. 2004;111(7): 1306.
17. McLaren JW, Nau CB, Erie JC, Bourne WM. Corneal thickness measurement by confocal microscopy, ultrasound, and scanning slit methods. Am J Ophthalmol. 2004;137(6):1011-20.
18. Javaloy J, Vidal MT, Villada JR, Artola A, Alió JL. Comparison of four corneal paquimetry techniques in corneal refractive surgery. J Refract Surg. 2004;20(1):29-34.
19. Brugin E, Ghirlando A, Gambato C, Midena E. Central corneal thickness: z-ring corneal confocal microscopy versus ultrasound pachymetry. Cornea. 2007; 26(3):303-7.
20. Balestrazzi A, Malandrini A, Traversi C, Martone G, Caporossi A. Air-guided manual deep anterior lamellar keratoplasty: long-term results and confocal microscopic findings. Eur J Ophthalmol. 2007;17(6):897-903.
21. Marchini G, Mastropasqua L, Pedrotti E, Nubile M, Ciancaglini M, Sbabo A. Deep lamellar keratoplasty by intracorneal dissection: a prospective clinical and confocal microscopic study. Ophthalmology. 2006;113(8):1289-300.
22. Ardjomand N, Hau S, McAlister JC, Bunce C, Galaretta D, Tuft SJ, Larkin DF. Quality of vision and graft thickness in deep anterior lamellar and penetrating corneal allografts. Am J Ophthalmol. 2007;143(2):228-35.
23. Shimazaki J, Shimmura S, Ishioka M, Tsubota K. Randomized clinical trial of deep lamellar keratoplasty vs penetrating keratoplasty. Am J Ophthalmol. 2002; 134(2):159-65.
24. Noble BA, Agrawal A, Collins C, Saldana M, Brogden PR, Zuberbuhler B. Deep Anterior Lamellar Keratoplasty (DALK): visual outcome and complications for a heterogeneous group of corneal pathologies. Cornea. 2007;26(1):59-64.
25. Fournié P, Coullet J, Moalic S, Malecaze F, Chapotot E, Arné JL. [Deep anterior lamellar keratoplasty in the surgical treatment of keratoconus. A 1-year follow-up]. J Fr Ophtalmol. 2006:29(6):602-13. French.
26. Fontana L, Parente G, Tassinari G. Clinical outcomes after deep anterior lamellar keratoplasty using the big-bubble technique in patients with keratoconus. Am J Ophthalmol. 2007;143(1):117-24.
27. Eggink FA, Nuijts RM. A new technique for rigid gas permeable contact lens fitting following penetrating keratoplasty. Acta Ophthalmol Scand. 2001;79(3): 245-50.
28. Wietharn BE, Driebe WT Jr. Fitting contact lenses for visual rehabilitation after penetrating keratoplasty. Eye Contact Lens. 2004;30(1):31-3.
29. Watson SL, Ramsay A, Dart JK, Bunce C, Craig E. Comparison of deep lamellar keratoplasty and penetrating keratoplasty in patients with keratoconus. Ophthalmology. 2004;111(9):1676-82.
30. Fogla R, Padmanabhan P. Results of deep lamellar keratoplasty using the big- bubble technique in patients with keratoconus. Am J Ophthalmol. 2006;141(2): 254-9. Comment in: Am J Ophthalmol. 2006;141(2):352-3.
Endereço para correspondência:
Jarbas Pereira de Macedo
Rua Luis Góis, 1.328 - Apto. 63
São Paulo (SP) CEP 04.043-150
E-mail: [email protected]
Recebido para publicação em 30.04.2008
Última versão recebida em 20.02.2009
Aprovação em 07.06.2009
Trabalho realizado no Departamento de Córnea e Doenças Externas do Hospital Oftalmológico de Sorocaba e na Eye Clinic Day Hospital - Sorocaba (SP) - Brasil.